2021-2022學年湖南省長沙市長郡中學高二(上)第一次模塊化學試卷
發布:2024/11/22 8:0:31
一、選擇題(本題包括10小題,每小題3分,共30分,在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.2019年12月以來,我國部分地區突發的新型冠狀病毒肺炎威脅著人們的身體健康。以下是人們在面對“新型冠狀病毒肺炎”時的一些認識,你認為符合科學道理的是( )
A.家庭消毒時,消毒液越濃越好 B.為了保證更好的消毒效果,將酒精和84消毒液混合使用 C.應經常保持室內清潔衛生和通風 D.為了節約時間,邊煮飯邊噴灑酒精對廚房進行消毒 組卷:82引用:2難度:0.6 -
2.中國努力爭取2060年前實現碳中和。下列說法不正確的是( )
A.積極鼓勵植樹造林,降低空氣中CO2含量 B.可利用CaO或氨水捕集廢氣中的CO2 C.一定條件下,將CO2轉化為CH3OH,實現CO2的資源化利用 D.研發新型催化劑將CO2分解成碳和O2,同時放出熱量 組卷:72引用:5難度:0.6 -
3.關于有效碰撞理論,下列說法正確的是( )
A.活化分子間所發生的所有碰撞為有效碰撞 B.增大反應物濃度能夠增大活化分子百分數,化學反應速率一定增大 C.升高溫度,活化分子百分數增加,化學反應速率一定增大 D.增大壓強,活化分子數一定增加,化學反應速率一定增大 組卷:132引用:16難度:0.9 -
4.反應A+B→C(△H<0)分兩步進行:①A+B→X(△H>0),②X→C(△H<0).下列示意圖中,能正確表示總反應過程中能量變化的是( )
A. 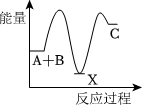
B. 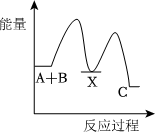
C. 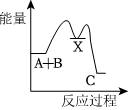
D. 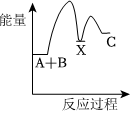 組卷:173引用:20難度:0.7
組卷:173引用:20難度:0.7 -
5.為探究濃度對化學平衡的影響,某同學進行如下實驗,下列說法不正確的是( )
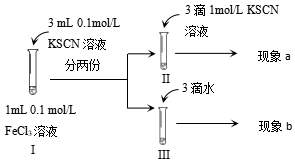
A.該實驗通過觀察顏色變化以判斷生成物濃度的變化 B.觀察到現象a比現象b中紅色更深,即可證明增加反應物濃度,平衡正向移動 C.進行Ⅱ、Ⅲ對比實驗的主要目的是防止由于溶液體積變化引起各離子濃度變化而干擾實驗結論得出 D.若Ⅰ中加入KSCN溶液的體積改為2mL也可以達到實驗目的 組卷:160引用:5難度:0.5 -
6.甲醇與水蒸氣重整可獲得清潔能源,在催化劑作用下發生如下兩步反應:
反應①:CH3OH(g)?CO(g)+2H2(g)△H1
反應②:CO(g)+H2O(g)?CO2(g)+H2(g)△H2
根據能量變化示意圖,下列說法不正確的是( )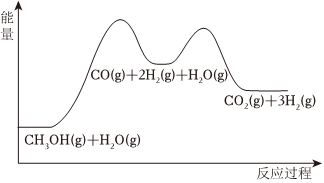
A.總反應的熱化學方程式為:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H=△H1+△H2 B.1mol CO(g)和1mol H2O(g)的總鍵能大于1mol CO2(g)和1mol H2(g)的總鍵能 C.甲醇與水蒸氣催化重整的總反應速率取決于反應① D.催化劑在反應中改變了活化能,加快了反應速率 組卷:78引用:4難度:0.8
三、非選擇題(本題共4小題,共54分)
-
17.高純超細氧化鋁是一種新型無機功能材料,以硫酸銨和硫酸鋁為原料制備復鹽硫酸鋁銨[NH4Al(SO4)2?12H2O],經硫酸鋁銨熱分解可制得高純超細氧化鋁,其流程如圖。
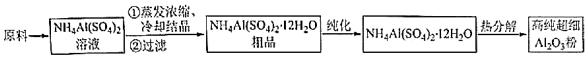
回答下列問題:
(1)操作①需加入稀H2SO4,其目的是。
(2)“純化”的方法為。
(3)實驗室用如下裝置利用熱分解法制備高純超細氧化鋁粉并對其分解氣成分進行探究: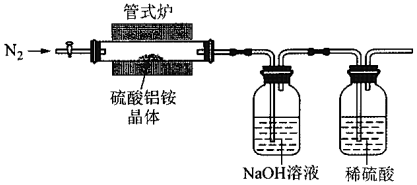
反應一段時間后,取三份NaOH吸收液于三支試管中分別進行如下實驗,填寫如表:
寫出硫酸鋁銨晶體高溫分解的化學方程式實驗步驟 實驗現象 實驗結論 ①加熱,將濕潤的紅色石蕊試紙置于試管口 試紙變藍 分解氣中含有 ②加入鹽酸酸化,再滴加氯化鋇溶液 產生白色沉淀 分解氣中 ③ 分解氣中不含有SO2 。
(4)為了測定高純超細氧化鋁粉中Al2O3的質量分數,可用EDTA(簡寫為H4Y)標準溶液滴定。取mg氧化鋁粉溶于鹽酸,加入過量的V1mL c1mol?L-1EDTA標準溶液,充分反應后,再用c2mol?L-1的Zn2+標準溶液滴定過量的EDTA至終點,消耗Zn2+標準溶液體積為V2mL。反應的離子方程式:Al3++Y4-═AlY-、Zn2++Y4-═ZnY22-。Al2O3的質量分數為。組卷:49引用:2難度:0.5 -
 18.三氧化鉬(MoO3)是石油工業中常用的催化劑,也是搪瓷釉藥的顏料,該物質常使用輝鉬礦(主要成分為MoS2)通過一定條件來制備。回答下列相關問題:
18.三氧化鉬(MoO3)是石油工業中常用的催化劑,也是搪瓷釉藥的顏料,該物質常使用輝鉬礦(主要成分為MoS2)通過一定條件來制備。回答下列相關問題:
(1)已知:①MoS2(s)?Mo(s)+S2(g)△H1;
②S2(g)+2O2(g)?2SO2(g)△H2;
③2Mo(s)+3O2(g)?2MoO3(s)△H3
則2MoS2(s)+7O2(g)?2MoO3(s)+4SO2(g)△H=(用含△H1、△H2、△H3的代數式表示)。
(2)若在恒溫恒容條件下僅發生反應MoS2(s)?Mo(s)+S2(g)
①下列說法正確的是(填字母)。
a.氣體的密度不變,則反應一定達到了 平衡狀態
b.氣體的相對分子質量不變,反應不定處于 平衡狀態
C.增加MoS2的量,平衡正向移動
②達到平衡時S2(g)的濃度為1.4 mol?L-1,充入一定量的S2(g),反應再次達到平衡,S2(g)濃度(填“>“<“或“=“)1.4 mol?L-1。
(3)在2L恒容密閉容器中充入1.0 molS2(g)和1.5 mol O2(g),若僅發生反應:S2(s)+2O2(g)?2SO2(g),5 min后反應達到平衡,此時容器壓強為起始時的80%,則0~5 min內,S2 (g)的反應速率為mol?L-1?min-1。
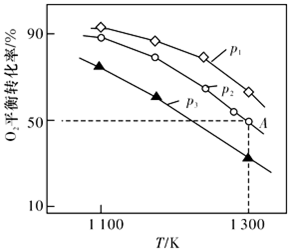
(4)在恒容密閉容器中,加入足量的MoS2和O2,僅發生反應:2MoS2(s)+7O2(g)?2MoO3(s)+4SO2(g)△H.測得氧氣的平衡轉化率與起始壓強、溫度的關系如圖所示:
①△H(填“>“*<“或“=“)0;比較p1、p2、p3的大小:
②若初始時通入7.0molO2,p2為7.0 kPa,則A點平衡常數Kp=(用氣體平衡分壓代替氣體平衡濃度計算。分壓=總壓×氣體的物質的量分數,寫出計算式即可)。組卷:25引用:3難度:0.4


