2022年湖北省十一校高考化學第二次聯考試卷
發布:2024/11/6 3:30:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.從2月4日開幕到2月20日閉幕,為期17天的精彩冬奧,“中國之美”與“五環之美”交相輝映,中國式浪漫撥動了全世界的心弦。下列冬奧會有關物品所用材料屬于合金的是( )




A冰墩墩的外殼 B奧運火炬材料中的碳纖維 C高亭宇的冰刀 D谷愛凌的滑板 A.A B.B C.C D.D 組卷:46引用:3難度:0.8 -
2.有人受中國傳統“水煙筒”的啟發,利用其工作原理,設計出了一個特殊的煙斗。內盛Cu(NH3)2Ac溶液(醋酸根簡寫為Ac-),煙氣通過煙斗發生如下反應:Cu(NH3)2Ac+CO+NH3?Cu(NH3)3Ac?CO ΔH<0。下列說法錯誤的是( )
A.物質Cu(NH3)2Ac為配合物 B.用這種特殊煙斗除去CO的實驗原理為洗氣 C.用久后的Cu(NH3)2Ac再生的適宜條件為升溫或降壓或適當增加酸度 D.[Cu(NH3)2]+中N原子形成的H-N-H鍵角小于氣態NH3中的鍵角 組卷:35引用:3難度:0.8 -
3.CalebinA 可用于治療阿爾茨海默病,在其合成過程中有如圖物質轉化過程:
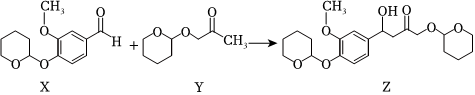
下列有關化合物X、Y和Z的說法正確的是( )A.X有3種含氧官能團 B.X、Y和Z均可發生水解反應 C.可用新制Cu(OH)2懸濁液檢驗Z中是否混有X D.將Z與NaOH乙醇溶液共熱,可發生消去反應 組卷:49引用:5難度:0.7 -
4.下列離子方程式正確的是( )
A.少量硫化氫氣體通入氯水中:H2S+Cl2=S↓+2Cl-+2H+ B.足量的Na2S與FeCl3反應:2Fe3++S2-=2Fe2++S↓ C.向H218O中投入Na2O2固體:2H218O+2Na2O2=4Na++4OH-+18O2↑ D.往Fe(NO3)3溶液中加入少量HI溶液:2Fe3++2I-=2Fe2++I2 組卷:44引用:2難度:0.6 -
5.摩爾鹽[(NH4)2Fe(SO4)2?6H2O]在定量分析中常用作標定高錳酸鉀等溶液的標準物質。某化學興趣小組以廢鐵屑、氨氣和稀硫酸為原料,制備少量摩爾鹽。結合裝置,判斷下列說法錯誤的是( )
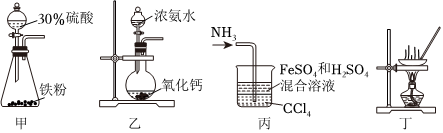
A.用裝置甲制取FeSO4溶液時鐵粉需要過量 B.用裝置乙制取NH3,NH3必須經過堿石灰干燥再通入裝置丙中 C.用裝置丙將氨氣通入FeSO4和H2SO4的混合溶液,不會倒吸 D.用裝置丁將溶液濃縮后,再降溫結晶,過濾可以得到(NH4)2Fe(SO4)2?6H2O晶體 組卷:58引用:3難度:0.4 -
6.NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1molD318O+(其中D代表 H)中含有的中子數為10NA21B.0.5molNaHSO4晶體中含有的離子數為1.5NA C.常溫,1LpH=9的Na2CO3溶液中水電離的H+數為10-9NA D.32gS8( 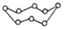 )與S6(
)與S6(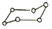 )的混合物中所含共價鍵數為NA組卷:17引用:2難度:0.5
)的混合物中所含共價鍵數為NA組卷:17引用:2難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.四氯化錫(SnCl4)是合成有機錫化合物的原料,制備SnCl4的裝置如圖所示。
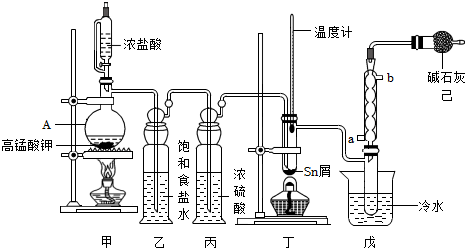
有關信息如表:
(1)儀器A的名稱為化學式 Sn SnCl2 SnCl4 熔點/℃ 232 246 -33 沸點/℃ 2260 652 114 其他性質 銀白色固體金屬 無色晶體,Sn2+易被Fe3+、I2等氧化為Sn4+ 無色液體,易水解生成SnO2?xH2O ,甲中發生反應的離子方程式為。
(2)如缺少裝置丙,丁處主要副反應的化學方程式為。
(3)加熱丁裝置,錫熔化,與Cl2反應,產物有SnCl4和SnCl2,為了確認丁中生成的SnCl2,可選用以下試劑(填序號)檢驗。
A.稀鹽酸
B.酸性高錳酸鉀
C.加入有KSCN的FeCl3溶液
(4)丁中反應需要通入過量的Cl2,并控制溫度在232~652℃范圍,控制溫度目的是。
(5)可以通過現象判斷丁中的反應已經完成。若制得的SnCl4顯黃色,可能的原因是。
(6)利用沉淀滴定法測定產品中Sn2+的含量,方案如下:準確稱取mg產品于錐形瓶中,用蒸餾水溶解,X溶液作指示劑,用bmol/L的硝酸銀標準溶液滴定,滴定終點時消耗硝酸銀溶液V1mL,由此可計算產品中Sn2+的質量分數。參考表中的數據,X溶液最好選用的是(填序號)。
A.NaCl溶液
B.NaBr溶液
C.NaCN溶液
D.Na2CrO4溶液
乙同學認為甲同學測得的Sn2+含量可能會偏高,理由難溶物 AgCl AgBr AgCN Ag2CrO4 顏色 白 淺黃 白 磚紅 Ksp 1.77×10-10 5.4×10-14 2.7×10-16 1.12×10-12 。組卷:35引用:2難度:0.4 -
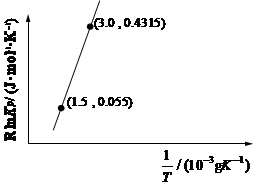 19.甲醇燃料是一種新的替代燃料,它和普通的汽油、柴油比較,優勢十分明顯。
19.甲醇燃料是一種新的替代燃料,它和普通的汽油、柴油比較,優勢十分明顯。
(1)目前正在開發用甲烷和氧氣合成甲醇:2CH4(g)+O2(g)2CH3OH(g),已知:RlnKp=-催化劑高溫高壓+C(C為常數)。根據圖中信息,恒壓條件下,溫度升高,KpΔHT(填“增大”、“減小”或“不變”);該反應的熱化學方程式為。
(2)在Cu催化作用下,甲烷氧化合成甲醇的總反應分兩步進行:
第一步為(寫化學方程式);
第二步為*CuH2+2-CH3+O2=Cu+2CH3OH。
第二步反應幾乎不影響總反應達到平衡所用的時間,由此推知,第二步反應活化能(填“大于”、“小于”或“等于”)第一步反應活化能。
(3)一定溫度下,恒容密閉容器中,CH4和O2按物質的量2:1混合合成氣態甲醇。下列事實能說明該反應達到平衡狀態的是(填選項字母)。
A.CH4和O2的轉化率之比不再改變
B.平衡常數不再改變
C.氣體密度不再改變
D.甲烷的體積分數不再改變
(4)某體積可變的密閉容器中,充入2molCH4和1molO2發生反應,2CH4(g)+O2(g)2CH3OH(g),CH4的平衡轉化率與溫度、壓強之間的關系如圖所示,已知:A點時容器體積為1L。催化劑高溫高壓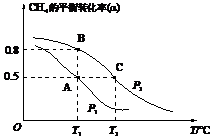
①B點時容器的體積為L。
②A、B、C三點的平衡常數KA、KB、KC由大到小的順序為。
③v正(O2)=k1?c2(CH4)?c(O2),v逆(CH3OH)=k2?c2(CH3OH),其中k1、k2為速率常數(只與溫度有關),則B點時,=k1k2。組卷:26引用:1難度:0.4


