2023-2024學年遼寧省名校聯(lián)盟高二(上)月考化學試卷(10月份)
發(fā)布:2024/9/27 6:0:3
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.遼寧省博物館是新中國建立的第一座博物館,館藏品總量達11.5萬件,以遼寧地區(qū)考古出土的文物和傳世的歷史藝術類文物為主體。下列文物的主要材質屬于金屬材料的是( )?
文物 
北宋“上京”款大晟南呂青銅編鐘
新石器時代紅山文化玉豬龍
元青花松竹梅紋八棱罐
遼“疊勝”琥珀小佩盒選項 A B C D A.A B.B C.C D.D 組卷:20引用:2難度:0.8 -
2.下列化學用語書寫正確的是( )
A.質子數(shù)為8、中子數(shù)為10的氧核素: O108B.羥基的電子式: 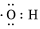
C.乙烯的空間填充模型: 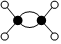
D.碳酸氫鈉在水溶液中的電離方程式:NaHCO3?Na++ HCO-3組卷:20引用:2難度:0.8 -
3.一定條件下,向一帶活塞、有釩觸媒的密閉容器中充入2mol SO2和1mol O2,發(fā)生反應:2SO2(g)+O2(g)?2SO3(g) ΔH=-198.0kJ?mol-1,則下列說法正確的是( )
A.該反應的逆方向低溫自發(fā) B.若容器絕熱,則化學反應速率會越來越快 C.保持溫度不變,達到平衡后,充入2mol N2,SO2的轉化率將減小 D. 不變,則該可逆反應已達到平衡狀態(tài)n(SO2)n(O2)組卷:25引用:4難度:0.6 -
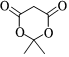 4.一種制備抗凝劑的原料M的結構簡式如圖。下列關于M的說法正確的是( )
4.一種制備抗凝劑的原料M的結構簡式如圖。下列關于M的說法正確的是( )A.分子式為C6H10O4 B.含有兩種官能團 C.一氯代物有2種(不考慮立體異構) D.所有碳原子可能共平面 組卷:16引用:3難度:0.8 -
 5.某興趣小組為研究物質的導電性設計了如圖裝置,現(xiàn)向試劑瓶X中分別加入20mL下列試劑,燈泡最亮的是( )
5.某興趣小組為研究物質的導電性設計了如圖裝置,現(xiàn)向試劑瓶X中分別加入20mL下列試劑,燈泡最亮的是( )A.0.1mol?L-1CH3COOH溶液 B.pH=13的氨水 C.0.1mol?L-1KAl(SO4)2溶液 D.pH=1的NaHSO4溶液 組卷:32引用:4難度:0.6 -
6.下列對生產(chǎn)、生活中事實的解釋正確的是( )
選項 事實 解釋 A 常溫下,濃硫酸可以用鐵罐儲存 常溫下,濃硫酸與鐵不反應 B NO2、N2O4平衡混合氣加壓后氣體顏色加深 加壓后平衡向生成NO2的方向移動 C 合成氨工業(yè)使用鐵觸媒作催化劑 催化劑既能加快反應速率,又能提高氫氣的平衡轉化率 D 將pH=12的NaOH溶液由25℃加熱至100℃后,pH變?yōu)?0 溫度升高,水的離子積常數(shù)增大 A.A B.B C.C D.D 組卷:25引用:2難度:0.7
二、非選擇題:本題共4小題,共55分。
-
18.常溫下,部分酸的電離常數(shù)如表所示
(1)c(H+)相同的三種酸,其酸的濃度從大到小順序為化學式 HF HCN H2CO3 電離常數(shù) Ka=3.5×10-4 Ka=3.6×10-10 Ka1=4.3×10-7,Ka2=5.6×10-11 。
(2)若HCN的起始濃度為0.1mol?L-1,平衡時c(H+)約為mol?L-1。若使此溶液中HCN的電離程度增大且c(H+)也增大的方法是。
(3)中和等量的NaOH,消耗等pH的氫氟酸和硫酸的體積分別為aL、bL,則a(填“大于”“小于”或“等于”,下同)b。
(4)向NaCN溶液中通入少量的CO2,發(fā)生反應的離子方程式為。
(5)25℃時,體積為10mL、pH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖,則HX的電離平衡常數(shù)(填“大于”“小于”或“等于”,下同)醋酸的電離平衡常數(shù),稀釋后,HX溶液中水電離出來的c(H+)醋酸溶液中水電離出來的c(H+)。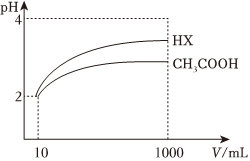 組卷:76引用:7難度:0.7
組卷:76引用:7難度:0.7 -
19.硫化氫(H2S)對黏膜有強烈的刺激作用,廣泛存在于石油化工、冶金等行業(yè)的廢氣中,脫除硫化氫對于保護環(huán)境有著現(xiàn)實而重要的意義。甲烷與硫化氫催化重整制取氫氣是脫除硫化氫的一種重要方法,主要反應為CH4(g)+2H2S(g)
CS2(g)+4H2(g)ΔH。催化劑高溫
已知:i.2H2S(g)?S2(g)+2H2(g)ΔH1=+170kJ?mol-1;
ii.CH4(g)+S2(g)?CS2(g)+2H2(g)ΔH2=+64kJ?mol-1。
回答下列問題:
(1)ΔH=kJ?mol-1,該反應的活化能:E正E逆(填“>”“<”或“=”)。
(2)在恒溫恒壓條件下,下列能說明催化重整反應達到平衡狀態(tài)的是(填字母)。
A.氣體的密度不再變化
B.v正(H2S)=2v逆(H2)
C.n(CH4):n(H2S):n(CS2):n(H2)=1:2:1:4
D.斷裂4個C-H鍵,同時斷裂2個C=S鍵
(3)向容積為2L的密閉容器中充入0.1molCH4和0.2molH2S,發(fā)生反應:CH4(g)+2H2S(g)CS2(g)+4H2(g),CH4的平衡轉化率與溫度(T)的關系如圖所示。催化劑高溫
①溫度升高,CH4的平衡轉化率增大的原因為。
②1500℃時,欲提高CH4的平衡轉化率,可以采取的措施是(填字母)。
A.充入He(g)
B.再充入一定量CH4(g)
C.再充入一定量H2S(g)
D.使用更高效的催化劑
③1500℃時,該反應的平衡常數(shù)K=(mol?L-1)2(保留三位有效數(shù)字)。
(4)向恒容密閉容器中充入nmol(n=1,2,3)的H2S(g),只發(fā)生反應i,測得H2S的平衡體積分數(shù)隨溫度的變化如圖所示,則n1=(填“1”“2”或“3”)mol。 組卷:18引用:2難度:0.5
組卷:18引用:2難度:0.5


