2018-2019學(xué)年湖南省株洲市醴陵一中高二(上)入學(xué)化學(xué)試卷
發(fā)布:2024/10/26 3:30:2
一、選擇題(本題包括16小題,每小題3分,共48分,每小題只有一個(gè)選項(xiàng)最符合題意.)
-
1.下列說(shuō)法中正確的是( )
A.在化學(xué)反應(yīng)過(guò)程中,發(fā)生物質(zhì)變化的同時(shí)不一定發(fā)生能量變化 B.生成物全部化學(xué)鍵形成時(shí)所釋放的能量大于破壞反應(yīng)物全部化學(xué)鍵所吸收的能量時(shí),反應(yīng)為吸熱反應(yīng) C.生成物的總能量大于反應(yīng)物的總能量時(shí),反應(yīng)吸熱,△H>0 D.△H的大小與熱化學(xué)方程式的計(jì)量系數(shù)無(wú)關(guān) 組卷:59引用:27難度:0.9 -
2.在2A(g)+B(g)?3C(g)+4D(g)中,表示該反應(yīng)速率最快的是( )
A.υA=0.5mol?L-1?min-1 B.υB=0.3mol?L-1?min-1 C.υC=0.8mol?L-1?min-1 D.υD=1mol?L-1?min-1 組卷:237引用:34難度:0.9 -
3.一定溫度下,濃度均為1mol/L的A2和B2兩種氣體,在密閉容器內(nèi)反應(yīng)生成氣體C,達(dá)平衡后,測(cè)得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L,則該反應(yīng)的正確表達(dá)式為( )
A.2A2+B2?2A2B B.A2+B2?2AB C.A2+B2?A2B2 D.A2+2B2?2AB2 組卷:189引用:23難度:0.9 -
4.下列各組變化中,前者小于后者的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
②2H2(g)+O2(g)═2H2O(l)△H1;
H2(g)+O2(g)═H2O(l)△H212
③t℃時(shí),在一定條件下,將1mol SO2和1mol O2分別置于恒容和恒壓的兩個(gè)密閉容器中,達(dá)到平衡狀態(tài)時(shí)反應(yīng)放出的熱量
④CaCO3(s)═CaO(s)+CO2(g)△H1
CaO(s)+H2O(l)═Ca(OH)2(s)△H2.A.①② B.②④ C.②③④ D.③④ 組卷:13引用:3難度:0.7 -
5.通過(guò)以下反應(yīng)均可獲取H2.下列有關(guān)說(shuō)法正確的是( )
①太陽(yáng)光催化分解水制氫:2H2O(l)═2H2(g)+O2(g)ΔH1=+571.6kJ?mol-1
②焦炭與水反應(yīng)制氫:C(s)+H2O(g)═CO(g)+H2(g)ΔH2=+131.3kJ?mol-1
③甲烷與水反應(yīng)制氫:CH4(g)+H2O(g)═CO(g)+3H2(g)ΔH3=+206.1kJ?mol-1。A.反應(yīng)①中電能轉(zhuǎn)化為化學(xué)能 B.反應(yīng)②為放熱反應(yīng) C.反應(yīng)③使用催化劑,ΔH3減小 D.反應(yīng)CH4(g)═C(s)+2 H2(g)的ΔH=+74.8kJ?mol-1 組卷:2065引用:90難度:0.9 -
6.鎳鎘(Ni-Cd)可充電電池在現(xiàn)代生活中有廣泛應(yīng)用,它的充放電反應(yīng)按下式進(jìn)行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O由此可知,該電池放電時(shí)的負(fù)極材料是( )充電放電A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH) 組卷:70引用:28難度:0.9 -
7.對(duì)可逆反應(yīng)4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列敘述正確的是( )
A.達(dá)到化學(xué)平衡時(shí),4v正(O2)=5v逆(NO) B.若單位時(shí)間內(nèi)生成x mol NO的同時(shí),消耗x molNH3,則反應(yīng)達(dá)到平衡 C.達(dá)到化學(xué)平衡時(shí),若增加容器體積,則正 反應(yīng)速率減少,逆反應(yīng)速率增加 D.化學(xué)反應(yīng)速率關(guān)系是2v正(NH3)=3v正(H2O) 組卷:47引用:10難度:0.7
二、解答題(共5小題,滿(mǎn)分52分)
-
20.請(qǐng)參考題中圖表,已知E1=134kJ?mol-1、E2=368kJ?mol-1,根據(jù)要求回答問(wèn)題:
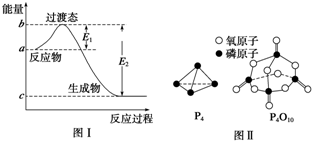
(1)圖Ⅰ是1mol NO2(g)和1mol CO(g)反應(yīng)生成CO2和NO過(guò)程中的能量變化示意圖,若在反應(yīng)體系中加入催化劑,反應(yīng)速率增大,E1的變化是(填“增大”、“減小”或“不變”,下同),△H的變化是.請(qǐng)寫(xiě)出NO2和CO反應(yīng)的熱化學(xué)方程式:.
(2)甲醇質(zhì)子交換膜燃料電池中將甲醇蒸汽轉(zhuǎn)化為氫氣的兩種反應(yīng)的熱化學(xué)方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-112
又知③H2O(g)═H2O(l)△H=-44kJ?mol-1,則甲醇蒸汽燃燒為液態(tài)水的熱化學(xué)方程式為.
(3)如表所示是部分化學(xué)鍵的鍵能參數(shù):
已知白磷的燃燒熱為d kJ?mol-1,白磷及其完全燃燒的產(chǎn)物的結(jié)構(gòu)如圖Ⅱ所示,則表中x=化學(xué)鍵 P-P P-O O═O P═O 鍵能/kJ?mol-1 a b c x kJ?mol-1(用含a、b、c、d的代數(shù)式表示).組卷:85引用:5難度:0.3 -
21.某研究小組向某2L密閉容器中加入一定量的固體A和氣體B,發(fā)生反應(yīng)A(s)+2B(g)?D(g)+E(g)ΔH=QkJ?mol-1.在T1℃時(shí),反應(yīng)進(jìn)行到不同時(shí)間測(cè)得各物質(zhì)的物質(zhì)的量如表:
(1)T1℃時(shí),該反應(yīng)的平衡常數(shù)K=時(shí)間(min)
物質(zhì)的量(mol)0 10 20 30 40 50 B 2.00 1.36 1.00 1.00 1.20 1.20 D 0 0.32 0.50 0.50 0.60 0.60 E 0 0.32 0.50 0.50 0.60 0.60 ;
(2)30min后,只改變某一條件,反應(yīng)重新達(dá)到平衡,根據(jù)表中的數(shù)據(jù)判斷改變的條件可能是(填字母編號(hào))。
a.通入一定量的B b.加入一定量的固體A c.適當(dāng)縮小容器的體積
d.升高反應(yīng)體系溫度 e.同時(shí)加入0.2molB、0.1molD、0.1molE
(3)對(duì)于該反應(yīng),用各物質(zhì)表示的反應(yīng)速率與時(shí)間的關(guān)系示意曲線(xiàn)為圖1中的(填序號(hào))。
(4)維持容器的體積和溫度T1不變,當(dāng)向該容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,達(dá)到平衡后,與表格中20分鐘時(shí)各物質(zhì)的濃度完全相同時(shí),則投入固體A的物質(zhì)的量n的取值范圍是。
(5)維持容器的體積和溫度T1不變,各物質(zhì)的起始物質(zhì)的量為n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,達(dá)到平衡后,n(E)=0.50 mol,則a=。
(6)若該密閉容器絕熱,實(shí)驗(yàn)測(cè)得B的轉(zhuǎn)化率B%隨時(shí)間變化的示意圖如圖2所示。由圖可知,Q0(填“大于”或“小于”),c點(diǎn)v正v逆(填“大于”“小于”或“等于”)。組卷:15引用:3難度:0.5


