2022-2023學年北京師大二附中高一(下)期中化學試卷
發布:2024/5/1 8:0:8
-
1.下列應用不合理的是( )
A.用SO2漂白紙漿、毛、絲等 B.用鐵質容器車運輸濃鹽酸 C.用高純硅可制造計算機芯片 D.用二氧化硅生產光導纖維 組卷:29引用:1難度:0.6 -
2.下列各組離子中,能大量共存的是( )
A.Na+、 、Cl-、OH-NH+4B. 、K+、Cl-、SO2-4NO-3C.H+、Fe2+、 、Na+NO-3D.Ca2+、Na+、 、OH-HSO-3組卷:43引用:1難度:0.7 -
3.下列冶煉金屬的原理不正確的是( )
A.電解飽和食鹽水制備金屬鈉 B.加熱分解Ag2O制備金屬銀 C.Fe2O3與CO高溫下反應制備金屬鐵 D.Fe與CuSO4溶液反應制備金屬銅 組卷:61引用:1難度:0.7 -
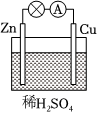 4.在如圖所示的原電池中,正極發生的反應是( )
4.在如圖所示的原電池中,正極發生的反應是( )A.2H++2e-═H2↑ B.Cu-2e-═Cu2+ C.Cu2++2e-═Cu D.Zn-2e-═Zn2+ 組卷:18引用:5難度:0.9 -
5.已知反應A+B=C+D的能量變化如圖所示,下列關于此反應的說法不正確的是( )
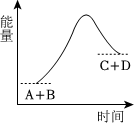
A.是吸熱反應 B.只有在加熱條件下才能進行 C.生成物的總能量高于反應物的總能量 D.反應中斷開化學鍵吸收的總能量高于形成化學鍵放出的總能量 組卷:148引用:12難度:0.9 -
6.下列解釋事實的化學用語正確的是( )
A.C和濃H2SO4反應:C+2H2SO4(濃) CO2↑+2SO2↑+2H2O△B.鐵和硫加熱條件下反應:2Fe+3S Fe2S3△C.過量鐵粉與稀硝酸反應:Fe+ +4H+=Fe3++NO↑+2H2ONO-3D.工業制粗硅:C+SiO2 Si+CO2↑高溫組卷:35引用:1難度:0.7
 II卷(58分) 
-
 18.氯化亞銅(CuCl)可用于冶金、電鍍等行業,其制備的一種工藝流程如下:
18.氯化亞銅(CuCl)可用于冶金、電鍍等行業,其制備的一種工藝流程如下:
Ⅰ.溶解:取海綿銅(主要含Cu和CuO),加入稀硫酸和NH4NO3的混合溶液,控制溶液溫度在60~70℃,不斷攪拌至固體全部溶解,得藍色溶液(過程中無氣體產生);
Ⅱ.轉化:向藍色溶液中加入(NH4)2SO3和NH4Cl,充分反應后過濾,得到CuCl粗品;
Ⅲ.洗滌:CuCl粗品依次用pH=2硫酸和乙醇洗滌,烘干后得到CuCl產品。
【資料】CuCl固體難溶于水,與Cl?反應生成可溶于水的絡離子[CuCl2]-;潮濕的CuCl固體露置于空氣容易被氧化。
(1)過程Ⅰ中:
①本工藝中促進海綿銅溶解的措施有。
②氧化銅溶解的離子方程式是。
③充分反應后的濃度約為反應前的2倍,原因是NH+4。
(2)過程Ⅱ中:
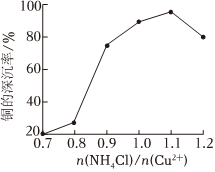
①(NH4)2SO3的作用是。
②NH4Cl的用量對銅的沉淀率的影響如圖所示。>1.1時,CuCl的沉淀率下降的原因是n(NH4Cl)n(Cu2+)(用離子方程式表示)。
(3)過程Ⅲ中,用乙醇洗滌的目的是。組卷:20引用:1難度:0.5 -
19.探究Na2SO3固體的熱分解產物。
資料:①4Na2SO3Na2S+3Na2SO4.。△
②Na2S能與S反應生成Na2Sx,Na2Sx與酸反應生成S和H2S。
③BaS易溶于水。
隔絕空氣條件下,加熱無水Na2SO3固體得到黃色固體A,過程中未檢測到氣體生成。黃色固體A加水得到濁液,放置得無色溶液B。
(1)檢驗分解產物Na2S
取少量溶液B,向其中滴加CuSO4溶液,產生黑色沉淀,證實有S2-.反應的離子方程式是。
(2)檢驗分解產物Na2SO4
取少量溶液B,滴加BaCl2溶液,產生白色沉淀,加入鹽酸,沉淀增多(經檢驗該沉淀含S),同時產生有臭雞蛋氣味的氣體(H2S),由于沉淀增多對檢驗造成干擾,另取少量溶液B,加入足量鹽酸,離心沉降(固液分離)后,(填操作和現象),可證實分解產物中含有SO42-。
(3)探究(2)中S的來源
來源1:固體A中有未分解的Na2SO3,在酸性條件下與Na2S反應生成S。
來源2:溶液B中有Na2Sx,加酸反應生成S。
針對來源1進行如下實驗: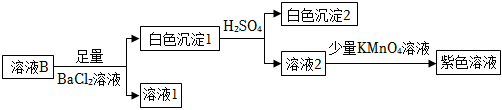
①實驗可證實來源1不成立。實驗證據是。
②不能用鹽酸代替硫酸的原因是。
③寫出來源2產生S的反應的離子方程式:。
(4)實驗證明Na2SO3固體熱分解有Na2S、Na2SO4和S產生。運用氧化還原反應規律分析產物中S產生的合理性:。組卷:1018引用:13難度:0.5


