蘇教版(2019)必修第二冊《 7.2 重要的含氮化工原料 》2021年同步練習卷(2)
發布:2024/12/12 10:30:1
一、選擇題
-
1.下列氣體去除雜質的方法中,不能實現目的的是( )
氣體(雜質) 方法 A SO2(H2S) 通過酸性高錳酸鉀溶液 B Cl2(HCl) 通過飽和的食鹽水 C N2(O2) 通過灼熱的銅絲網 D NH3(H2O) 通過堿石灰 A.A B.B C.C D.D 組卷:58引用:2難度:0.7 -
2.下列敘述不正確的是( )
A.NH3的噴泉實驗說明氨氣極易溶于水 B.NH3中的N元素只具有還原性 C.NO和NH3均可用排空氣法收集 D.NH3遇到揮發性強酸能產生白煙 組卷:3引用:1難度:0.6 -
3.下列反應中,氨既表現還原性,又表現堿性的是( )
A.8NH3+3Cl2=N2+6NH4Cl B.4NH3+5O2 4NO+6H2OPt△C.2NH3+3CuO 3Cu+N2+3H2O△D.2NH3+H2SO4=(NH4)2SO4 組卷:9引用:1難度:0.7 -
4.某化學研究小組用中學實驗常見的玻璃儀器完成了在常壓、酒精燈加熱條件下合成氨反應裝置的設計,實驗裝置和藥品如圖所示。下列說法錯誤的是(已知:NaNO2+NH4Cl
NaCl+N2↑+2H2O△H<0)( )冰醋酸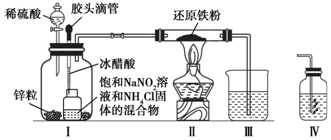
A.實驗開始后,應先通入反應氣體,再點燃酒精燈 B.在通風櫥中進行該反應,若稀硫酸和鋅粒產生的H2足夠多,能避免檢驗NH3性質時可能引起的倒吸 C.為避免尾氣造成的環境污染,應將裝置Ⅲ更換為如圖IV的裝置 D.因NH4Cl和NaNO2的反應放熱,故應將冰醋酸緩緩加入小廣口瓶中 組卷:10引用:1難度:0.5 -
5.學好化學,須特別注重基礎知識的積累和整理,比如常見的干燥劑有濃硫酸、堿石灰、無水CaCl2等,但干燥劑的選擇卻是有講究的。通常情況下,下列各組物質能夠共存且能用濃硫酸來干燥的氣體是( )
A.HCl、NH3、CO2 B.NH3、N2、H2 C.SO2、H2S、O2 D.H2、O2、N2 組卷:24引用:2難度:0.7 -
6.南山有諺曰:“折桂樓前有池,池中有噴泉,逢節即現”。噴泉產生的原理是壓強差,化學課上我們學習了利用氨氣極易溶于水的性質的“噴泉實驗”,下列試劑組合也能產生噴泉的是( )
A.CO2氣體和NaHCO3溶液 B.SO2氣體和NaHSO3溶液 C.Cl2氣體和飽和食鹽水 D.HCl氣體和NaOH溶液 組卷:59引用:3難度:0.7
二、實驗題
-
17.氨氣和氨水在工農業生產中均有重要應用。

(1)工業合成氨反應的化學方程式是。
(2)實驗室常加熱熟石灰[主要成分是Ca(OH)2]和氯化銨混合固體制取氨氣,寫出反應的化學方程式。
(3)如圖所示,向表面皿中的NaOH固體滴幾滴濃氨水,迅速蓋上蓋,觀察現象。
①液滴上方會出現白煙(填序號)
A.濃鹽酸
B.濃硫酸
C.FeCl3溶液
②一段時間后濃硫酸的液滴中有白色固體,生成該白色固體的化學方程是。
③FeCl3液滴中出現的現象是,發生反應的離子方程式是。
(4)濃氨水可以用來檢驗有毒氣體(如:氯氣)的泄漏,反應式為3Cl2+8NH3=N2+6NH4Cl,在該反應中,氧化劑是(填化學式),檢測時觀察到的現象是,當有1mol氮氣生成時,轉移的電子數是mol。組卷:28引用:4難度:0.6
三、工業流程題
-
18.工業上用廢銅屑(含雜質鐵)制備硫酸銅晶體(膽礬)的流程如下,請回答有關問題:

(1)加入H2O2溶液的目的是(用離子方程式表示)。
(2)由溶液E制備純凈膽礬的“一系列操作”包括、洗滌、低溫干燥。洗滌晶體時用乙醇代替蒸餾水的目的是,并縮短干燥所需時間。
(3)實驗室中Cu(含雜質鐵)可在如圖所示裝置(夾持、加熱裝置省去未畫)內發生反應生成硫酸銅和少量硫酸鐵,再進一步從所得溶液中獲得硫酸銅晶體。
①銅與稀硫酸和稀硝酸的混合酸發生反應的實驗現象為;該實驗中最好控制所加HNO3和H2SO4的物質的量之比為。
②若使用的硝酸是濃硝酸,則銅與混合酸反應生成的兩種氣體是(填化學式);若這兩種氣體與NaOH溶液反應后只生成一種鹽,則該反應的化學方程式為。組卷:139引用:3難度:0.5


