2021-2022學(xué)年山西省運(yùn)城市康杰中學(xué)高二(上)期末化學(xué)試卷
發(fā)布:2024/12/18 13:0:2
一、選擇題(本大題共20小題,每小題3分,共計(jì)60分.在每小題列出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的)
-
1.化學(xué)與生活密切相關(guān),下列說(shuō)法正確的是( )
A.K2FeO4可用于飲水的消毒凈化 B.電解氯化鎂溶液可制備單質(zhì)鎂 C.氫能、生物質(zhì)能是可再生的一次能源 D.使用加酶洗衣粉時(shí),溫度越高效果越好 組卷:26引用:5難度:0.6 -
2.下列各基態(tài)原子或離子的核外電子排布式正確的是( )
A.2He:1s12s1 B.12Mg2+:1s22s22p63s2 C.16S2-:1s22s22p63s23p6 D.24Cr:1s22s22p63s23p63d44s2 組卷:39引用:2難度:0.6 -
3.下列有關(guān)比較中錯(cuò)誤的是( )
A.元素的電負(fù)性:N<O<F B.元素的金屬性:Na>Mg>Al C.元素的第一電離能:C<N<O D.元素的最高正價(jià):P<S<Cl 組卷:5引用:5難度:0.7 -
4.鋰(Li)在能源、航天等工業(yè)上應(yīng)用廣泛.已知1gLi完全燃燒生成固態(tài)Li2O時(shí)放出熱量為42.9kJ。則Li燃燒的熱化學(xué)方程式正確的是( )
A.2Li+ O2═Li2OΔH=-85.8kJ?mol-112B.2Li(s)+ O2(g)═Li2O(s)ΔH=+85.8kJ?mol-112C.2Li(s)+ O2(g)═Li2O(g)ΔH=-600.6kJ?mol-112D.Li(s)+ O2(g)═14Li2O(s)ΔH=-300.3kJ?mol-112組卷:23引用:3難度:0.6 -
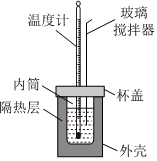 5.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。某同學(xué)使用如圖所示的裝置測(cè)定中和熱。下列關(guān)于該實(shí)驗(yàn)的說(shuō)法錯(cuò)誤的是( )
5.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。某同學(xué)使用如圖所示的裝置測(cè)定中和熱。下列關(guān)于該實(shí)驗(yàn)的說(shuō)法錯(cuò)誤的是( )A.測(cè)定一次至少需要測(cè)量并記錄三次溫度 B.若用銅棒代替玻璃攪拌器,測(cè)得的ΔH小于-57.3kJ?mol-1 C.若用濃硫酸替代稀鹽酸進(jìn)行實(shí)驗(yàn),測(cè)得的ΔH小于-57.3kJ?mol-1 D.該實(shí)驗(yàn)需要計(jì)算生成水的物質(zhì)的量 組卷:97引用:7難度:0.8 -
6.有機(jī)物CH2═CH-CH═CH2與H2按1:1發(fā)生加成反應(yīng)可得H2C═CH-CH2-CH3和CH3-CH═CH-CH3兩種產(chǎn)物,其能量與反應(yīng)進(jìn)程如圖所示,下列說(shuō)法不正確的是( )
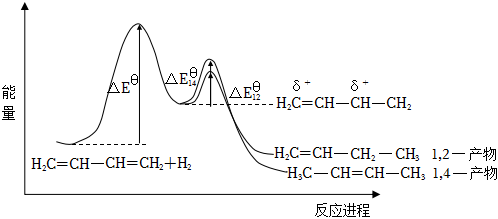
A.生成1,4-產(chǎn)物和1,2-產(chǎn)物均為放熱反應(yīng) B.溫度高、時(shí)間長(zhǎng)不利于1,2-產(chǎn)物生成 C.加入催化劑可以降低ΔEθ的值 D.1,2-產(chǎn)物的穩(wěn)定性高于1,4-產(chǎn)物的 組卷:4引用:1難度:0.6 -
7.山東艦是我國(guó)自主研制的新型航母,為了延長(zhǎng)航母服役壽命可以在航母艦體(主要成分是鋼鐵合金)上鑲嵌金屬鋅。下列有關(guān)說(shuō)法正確的是( )
A.可以用鉛等金屬代替鋅 B.構(gòu)成原電池反應(yīng)時(shí),艦體表面發(fā)生氧化反應(yīng) C.這種保護(hù)方法叫犧牲陽(yáng)極的陰極保護(hù)法 D.在酸雨環(huán)境中,航母主要發(fā)生吸氧腐蝕 組卷:18引用:3難度:0.7 -
8.下列事實(shí)中,不能用勒夏特列原理解釋的是( )
A.鋼鐵在潮濕的空氣中容易生銹 B.開(kāi)啟啤酒后,瓶中馬上泛起大量泡沫 C.實(shí)驗(yàn)室中常用排飽和食鹽水的方法收集氯氣 D.工業(yè)生產(chǎn)硫酸的過(guò)程中使用過(guò)量的空氣以提高二氧化硫的利用率(2SO2+O2?2SO3) 組卷:23引用:3難度:0.5
二、非選擇題(本題共4小題,共40分)
-
23.高錳酸鉀是重要的氧化劑.回答下列問(wèn)題:
Ⅰ.某實(shí)驗(yàn)小組用硫酸酸化的亞硫酸鈉溶液滴定KMnO4溶液(兩者反應(yīng)后氧化產(chǎn)物和還原產(chǎn)物分別為SO42-、Mn2+),測(cè)定KMnO4溶液濃度.步驟如下:
①將一定量的高錳酸鉀加入燒杯中,倒入蒸餾水使其溶解;
②取0.100mol?L-1的亞硫酸鈉溶液25.00mL置于錐形瓶中,加入適量稀H2SO4酸化,再用KMnO4溶液滴定至終點(diǎn),重復(fù)滴定兩次,平均消耗VmLKMnO4溶液.
(1)高錳酸鉀溶液盛放在(填“酸式”或“堿式”)滴定管中.
(2)滴定到達(dá)終點(diǎn)的現(xiàn)象是.
(3)該KMnO4溶液的物質(zhì)的量濃度為mol?L-1.
Ⅱ.另一實(shí)驗(yàn)小組設(shè)計(jì)如表所示實(shí)驗(yàn)方案,探究25℃時(shí)酸性高錳酸鉀溶液與Na2SO3溶液反應(yīng)時(shí),影響反應(yīng)速率的因素:
(4)通過(guò)測(cè)定反應(yīng)達(dá)到終點(diǎn)所用的時(shí)間計(jì)算反應(yīng)速率的大小.已知實(shí)驗(yàn)1反應(yīng)達(dá)到終點(diǎn)所用的時(shí)間是2min,則該時(shí)間段內(nèi)反應(yīng)速率v(MnO4-)=編號(hào) 0.2mol?L-1的Na2SO3溶液/mL 0.1mol?L-1的KMnO4溶液/mL 0.6mol?L-1的H2SO4溶液/mL 0.1mol?L-1的MnSO4溶液/mL V(H2O)/mL 1 3.0 2.0 1.0 0 2.0 2 3.0 2.0 2.0 0 1.0 3 4.0 2.0 2.0 0 0 4 3.0 2.0 1.0 0.5 a mol?L-1?min-1.
(5)實(shí)驗(yàn)2和實(shí)驗(yàn)3的目的是;實(shí)驗(yàn)測(cè)得實(shí)驗(yàn)2的反應(yīng)速率大于實(shí)驗(yàn)1,結(jié)論是.
(6)a=,實(shí)驗(yàn)測(cè)得實(shí)驗(yàn)4的反應(yīng)速率明顯大于實(shí)驗(yàn)1,某同學(xué)在一定溫度下進(jìn)行酸性高錳酸鉀溶液與Na2SO3溶液的反應(yīng)時(shí),發(fā)現(xiàn)剛開(kāi)始一段時(shí)間,反應(yīng)速率較慢,后來(lái)反應(yīng)速率明顯加快,該實(shí)驗(yàn)中反應(yīng)速率明顯加快的原因可能是.組卷:6引用:1難度:0.6 -
24.工業(yè)上利用廢鎳催化劑(主要成分為NiO,還含有一定量的ZnO、Fe2O3、SiO2、CaO等)制備一水合氫氧化氧鎳(2NiOOH?H2O)的工藝流程如圖:
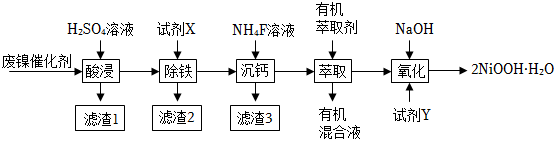
相關(guān)金屬離子[c0(Xn+)=0.1mol?L-1]形成氫氧化物沉淀的pH范圍如表:
回答下列問(wèn)題:金屬離子 Ca2+ Zn2+ Ni2+ Fe3+ 開(kāi)始沉淀時(shí)的pH 10.6 7.6 7.1 1.5 完全沉淀時(shí)的pH 13.1 8.3 9.2 2.8
(1)寫(xiě)出一種能提高“酸浸”速率的措施:;濾渣1的成分是(填化學(xué)式).
(2)試劑X用于調(diào)節(jié)溶液的pH,則調(diào)控pH的范圍是.
(3)已知“除鐵”后所得100mL溶液中c(Ca2+)=0.01mol?L-1,加入100mLNH4F溶液(忽略混合后溶液體積的變化),使Ca2+恰好沉淀完全[此時(shí)c(Ca2+)=1×10-5mol?L-1],則所加溶液c(NH4F)=mol?L-1[已知實(shí)驗(yàn)條件下,Ksp(CaF2)=4×10-9,不考慮F-的水解].
(4)“氧化”“過(guò)程中加入的試劑Y可以是NaClO、K2S2O8、KMnO4等,寫(xiě)出加入K2S2O8反應(yīng)生成一水合氫氧化氧鎳(2NiOOH?H2O)的離子方程式:.
(5)加入有機(jī)萃取劑的作用是.
(6)已知工業(yè)上也可以用Ni(OH)2作為陽(yáng)極、NaOH溶液為電解質(zhì)溶液,通過(guò)電解氧化法制備N(xiāo)iOOH,其陽(yáng)極的電極反應(yīng)式為.組卷:57引用:2難度:0.6


