2022-2023學年天津四十七中高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、第I卷(選擇題1-12題,滿分36分)
-
1.2021年神舟十二號載人飛船成功將3名航天員送入中國空間站,這是中國人首次進入自己的空間站。下列說法錯誤的是( )
A.太陽電池翼伸展機構用到的SiC是一種新型合金材料 B.空間站中用Na2O2將CO2轉化為O2,Na2O2含離子鍵和非極性鍵 C.運載火箭的燃料偏二甲肼(C2H8N2)燃燒過程中化學能轉化為熱能 D.天和核心艙采用電推發動機“燃料” Xe原子核含77個中子13154組卷:21引用:1難度:0.7 -
2.下列敘述正確的是( )
A.鉛酸蓄電池充電時,PbSO4在兩電極上生成 B.煤的“氣化”、煤的“液化”、煤的“干餾”都是化學變化 C.常溫下,pH均為5的鹽酸與氯化銨溶液中,水電離的氫離子濃度相等 D.298K時,反應2Mg(s)+CO2(g)═C(s)+2MgO(s)能自發進行,則該反應的ΔH>0 組卷:42引用:1難度:0.7 -
3.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.將1molSO2通入水中,H2SO3、HSO3-、SO32-粒子數之和為NA B.標準狀況下,22.4LHF溶于水,溶液中HF與F-數目之和為NA C.將1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+數目為NA D.25℃1LpH=1的H3PO4溶液中H+數目小于0.1NA 組卷:29引用:1難度:0.6 -
4.常溫下,下列溶液中各組離子一定能夠大量共存的是( )
A.水電離出來的c(OH-)=1.0×10-13mol/L的溶液:K+、Cl-、S2-、SO32- B. =1.0×10-12的溶液:K+、Na+、CO32-、AlO2-c(H+)c(OH-)C.使甲基橙變紅色的溶液中:Na+、NH4+、S2O32-、SO32- D.通入足量SO2后的溶液:Na+、Ba2+、ClO-、CH3COO- 組卷:31引用:1難度:0.6 -
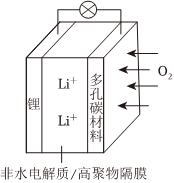 5.一種可充電鋰—空氣電池如圖所示。當電池放電時,O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)。下列說法不正確的是( )
5.一種可充電鋰—空氣電池如圖所示。當電池放電時,O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)。下列說法不正確的是( )A.放電時,多孔碳材料電極為正極 B.放電時,外電路電流由多孔碳材料電極流向鋰電極 C.充電時,多孔碳材料電極反應為Li2O2-x-2e-=2Li++(1- )O2↑x2D.充電時,電解質溶液中Li+向多孔碳材料區遷移 組卷:48引用:1難度:0.6
二、解答題(共4小題,滿分64分)
-
15.亞硝酰硫酸(NOSO4H)是一種淺黃色液體,遇水易分解,溶于濃硫酸,主要用于染料、醫藥領域的重氮化反應。實驗室用如圖裝置(夾持裝置略)制備少量NOSO4H,并測定產品中雜質硝酸的含量。
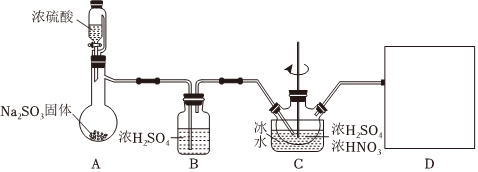
回答下列問題:
(1)裝置A中盛裝Na2SO3固體的儀器名稱是,裝置D最好選用(填序號)。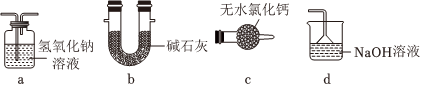
(2)裝置C中濃HNO3與SO2在濃H2SO4作用下反應制得NOSO4H。
①C中“冷水”的溫度一般控制在20℃,裝置C中溫度過高產率降低的原因是。
②開始通SO2時,反應緩慢,待生成少量NOSO4H后,溫度變化不大,但反應速率明顯加快,其原因是。
③請寫出亞硝酰硫酸(NOSO4H)與水分解時發生的化學方程式(已知亞硝酸不穩定,易分解,亞硝酸發生分解反應的方程式為2HNO2=NO2↑+NO↑+H2O)。
(3)測定亞硝酰硫酸產品中雜質硝酸的含量。
稱取1.400g產品放入250mL錐形瓶中,加80mL濃硫酸,用0.1000mol/L(NH4)2Fe(SO4)2標準溶液滴定,消耗標準溶液20.00mL。
已知:(NH4)2Fe(SO4)2可與NO生成粉紅色的FeSO4?NO。
①滴定過程中錐形瓶內發生的離子方程式為。
②錐形瓶中加入濃硫酸除了可以作溶劑外,另一個作用是。
③下列操作造成測定結果偏高的是(填字母)。
A.滴定終點滴定管讀數時俯視讀數
B.用容量瓶配制(NH4)2Fe(SO4)2標準溶液時俯視
C.酸式滴定管用蒸餾水洗凈后,未用標準液潤洗
D.滴定前,盛裝標準液的滴定管尖嘴有氣泡,滴定后氣泡消失
④判斷滴定達到終點的現象是。
⑤亞硝酰硫酸中硝酸的含量為。組卷:760引用:1難度:0.4 -
16.Ⅰ.利用甲醇(CH3OH)制備一些高附加值產品,是目前研究的熱點。
(1)甲醇和水蒸氣經催化重整可制得氫氣,反應主要過程如下:
反應Ⅰ.CH3OH(g)+H2O(g)?3H2(g)+CO2(g)△H1
反應Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=akJ?mol-1
反應Ⅲ.CH3OH(g)?2H2(g)+CO(g)△H3=bkJ?mol-1
①△H1=kJ?mol-1。
②工業上采用CaO吸附增強制氫的方法,可以有效提高反應Ⅰ氫氣的產率,如圖1,請分析加入CaO提高氫氣產率的原因:。
(2)CO2和H2充入一定體積的密閉容器中,在兩種溫度下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),測得CH3OH的物質的量隨時間的變化如圖2。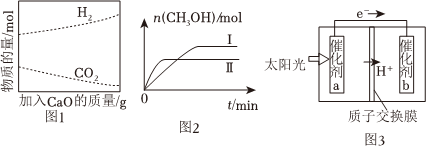
①曲線Ⅰ、Ⅱ對應的平衡常數大小關系為KⅠKⅡ。(填“>”或“=”或“<”)
②一定溫度下,在容積為1L的兩個恒容密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
若甲中平衡后氣體的壓強為開始的0.8倍,則乙容器起始時反應速率v正容器 甲 乙 反應物投入量 1mol CO2、3mol H2 1mol CO2、1mol H2、
1mol CH3OH(g)、1mol H2O(g)v逆。(填“>”“<”或“=”)。
③一定溫度下,此反應在恒壓容器中進行,能判斷該反應達到化學平衡狀態的依據是。
a.容器中壓強不變
b.H2的體積分數不變
c.c(H2)=3c(CH3OH)
d.容器中密度不變
e.2個C=O斷裂的同時有3個H-H斷裂
Ⅱ.(3)已知電離常數HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,則向KCN溶液中通入少量CO2時的離子方程式為。
Ⅲ.(4)利用人工光合作用,借助太陽能使CO2和H2O轉化為HCOOH,如圖3所示,在催化劑b表面發生的電極反應為:。組卷:90引用:4難度:0.7


