2022-2023學年北京市西城區高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、第一部分本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列裝置或過程能實現電能轉化為化學能的是( )

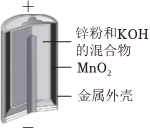
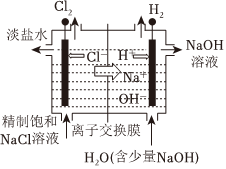
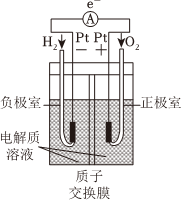
A.火力發電 B.堿性鋅錳電池 C.電解飽和食鹽水 D.氫氧燃料電池 A.A B.B C.C D.D 組卷:37引用:3難度:0.7 -
2.下列物質中,屬于強電解質的是( )
A.CH3COOH B.H2O C.NH3?H2O D.NaOH 組卷:59引用:5難度:0.9 -
3.關于化學反應速率增大的原因,下列分析不正確的是( )
A.有氣體參加的化學反應,增大壓強使容器容積減小,可使單位體積內活化分子數增多 B.增大反應物的濃度,可使活化分子之間發生的碰撞都是有效碰撞 C.升高溫度,可使反應物分子中活化分子的百分數增大 D.使用適宜的催化劑,可使反應物分子中活化分子的百分數增大 組卷:100引用:4難度:0.7 -
4.下列化學用語書寫不正確的是( )
A.Cl-的結構示意圖: 
B.NaCl的電子式: 
C.基態銅原子(29Cu)的價層電子排布式:3d94s2 D.基態氧原子的軌道表示式:  組卷:22引用:1難度:0.6
組卷:22引用:1難度:0.6 -
5.下列用于解釋事實的化學用語書寫不正確的是( )
A.電解精煉銅的陽極反應:Cu2++2e-═Cu B.用Na2CO3溶液清洗油污的原因:H2O+CO32-?HCO3-+OH- C.用飽和Na2CO3溶液處理鍋爐水垢中的CaSO4:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) D.將純水加熱至較高溫度,水的pH<7:H2O?H++OH-ΔH>0 組卷:19引用:1難度:0.7 -
6.下列說法正確的是( )
A.2p、3p、4p能級的軌道數依次增多 B.所有非金屬元素都分布在p區 C.最外層電子數為2的元素都分布在s區 D.元素周期表中從第ⅢB族到第ⅡB族的10個縱列的元素都是金屬元素 組卷:37引用:3難度:0.7
二、解答題(共6小題,滿分58分)
-
19.三氧化二砷(As2O3)是重要的化工原料,某以含砷廢水制備三氧化二砷的流程如圖。

資料:
ⅰ.含砷廢水的主要成分:HAsO2(亞砷酸)、H2SO4、Fe2(SO4)3、Bi2(SO4)3(硫酸鉍)。
ⅱ.相關難溶電解質的溶度積:
(1)純化難溶電解質 Fe(OH)3 Bi(OH)3 Ksp 4.0×10-38 4.0×10-31
①當溶液中剩余離子的濃度小于1×10-5mol?L-1時,認為該離子已被完全除去。常溫下,若純化過程中控制溶液的pH=6,(填“能”或“不能”)將Fe3+和Bi3+完全除去。
②充分反應后,分離出精制含砷廢水的方法是。
(2)還原浸出
①補全還原浸出過程發生主要反應的化學方程式:Cu(AsO2)2+SO2+═Cu3(SO3)2?2H2O+HAsO2+。
②其他條件相同時,還原浸出60min,不同溫度下砷的浸出率如圖。隨著溫度升高,砷的浸出率先增大后減小的原因是。
③還原渣經過充分氧化處理,可返回工序,循環利用。
a.純化
b.沉砷
c.還原
(3)測定產品純度取agAs2O3產品,加適量硫酸溶解,以甲基橙作指示劑,用bmol?L-1KBrO3溶液滴定,終點時生成H3AsO4和Br-,消耗cmLKBrO3溶液。As2O3產品中As2O3的質量分數是。(As2O3的摩爾質量為198g?mol-1)組卷:69引用:2難度:0.6 -
20.某小組探究含Cr元素的化合物間的轉化,進行如下實驗。資料:
ⅰ.含Cr元素的常見粒子:Cr2(橙色)、O2-7(黃色)、CrO5(溶于水,藍紫色,不穩定)、Cr3+(綠色)、Cr(OH)3(藍灰色,難溶于水,可溶于強酸、強堿)、Cr(OH)4-(亮綠色)。CrO2-4
ⅱ.H2O2在堿性環境中比在酸性環境中分解速率快。
ⅲ.在堿性環境中,O2不能氧化+3價鉻元素。實驗操作及現象如下:
(1)已知Cr2裝置 步驟 操作 現象 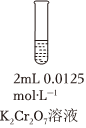
Ⅰ 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振蕩 溶液橙色加深。滴入H2O2溶液后迅速變為藍紫色,有氣泡生成。稍后,無明顯氣泡時,溶液由藍紫色完全變為綠色 Ⅱ 繼續緩慢滴入10滴2mol?L-1NaOH溶液,邊滴,邊振蕩 又有氣泡生成,溶液最終變為黃色 (橙色)+H2O?2O2-7(黃色)+2H+。請用化學平衡移動原理解釋Ⅰ中滴入稀硫酸后溶液橙色加深的原因:CrO2-4。
(2)Ⅰ中,溶液由橙色變為綠色的總反應的離子方程式是。
(3)Ⅱ中,繼續滴入NaOH溶液后,又有氣泡生成的原因是。
(4)Ⅱ中,繼續滴入NaOH溶液后,預測有Cr(OH)3沉淀生成,但實驗時未觀察到。提出假設:在堿性環境中,+3價鉻元素被H2O2氧化。
①甲同學設計實驗證明假設成立:取少量Ⅰ中的綠色溶液,在滴入NaOH溶液前增加一步操作:。然后滴入NaOH溶液,有藍灰色沉淀生成,繼續滴入NaOH溶液,沉淀溶解,溶液變為色。
②乙同學進一步研究堿性環境對+3價鉻元素的還原性或H2O2的氧化性的影響,設計如圖實驗。右側燒杯的溶液中,氧化劑是。
開始時靈敏電流計指針不偏轉,分別繼續進行如下實驗。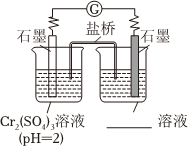
ⅰ.向左側燒杯中滴入NaOH溶液,出現藍灰色沉淀,繼續緩慢滴入NaOH溶液,靈敏電流計指針向右偏轉(電子從左向右運動),此時左側的電極反應式為。
ⅱ.向右側燒杯中滴入NaOH溶液,有微小氣泡生成,靈敏電流計指針向左偏轉,左側無明顯變化。此時原電池中的總反應的化學方程式為。
(5)由上述實驗,Cr2與H2O2、O2-7與H2O2的氧化性強弱(填“>”或“<”):CrO2-4
酸性條件下,Cr2O2-7H2O2;
堿性條件下,CrO2-4H2O2。組卷:32引用:2難度:0.6


