2022-2023學年北京八十中高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.宇航員在天宮實驗室進行水球實驗。下列有關水的說法不正確的是( )
A.H2O分子的共價鍵是s-sσ鍵 B.H2O分子之間可以形成氫鍵 C.H2O分子的空間構型是V字型 D.H2O分子內有極性共價鍵,H2O分子是極性分子 組卷:56引用:3難度:0.6 -
2.下列說法正確的是( )
A.硫酸銨和醋酸鉛溶液均可使雞蛋清溶液中的蛋白質變性 B.麥芽糖與蔗糖的水解產物均含葡萄糖,故二者均為還原型二糖 C.天然植物油常溫下一般呈液態,難溶于水,有恒定的熔點、沸點 D.蛋白質的鹽析可用于分離和提純蛋白質 組卷:58引用:2難度:0.7 -
3.下列化學用語對事實的表述不正確的是( )
A.工業上用乙醛催化氧化法制乙酸:2CH3CHO+O2 2CH3COOH催化劑△B.苯酚鈉溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- C.用Na2S除去工業廢水中的Hg2+:Hg2++S2-═HgS↓ D.用明礬凈水:Al3++3H2O?Al(OH)3(膠體)+3H+ 組卷:19引用:2難度:0.6 -
4.電導率可衡量電解質溶液導電能力大小。室溫下,用0.100mol/LNH3?H2O滴定10mL濃度均為0.100mol/LHCl和CH3COOH的混合液,電導率如圖所示。下列說法正確的是( )

A.①溶液中c(H+)為0.200mol/L B.溶液溫度高低為①>③>② C.③點溶液中有c(Cl-)>c(CH3COO-) D.③點后因離子數目減少使電導率略降低 組卷:20引用:2難度:0.6 -
5.短周期元素X、Y、Z、W的原子序數依次增大。用表中信息判斷下列說法正確的是( )
元素 X Y Z W 最高價氧化物的水化物 H3ZO4 0.1mol?L-1溶液對應的pH(25℃) 1.00 13.00 1.57 0.7 A.元素電負性:Z<W B.簡單離子半徑:W<Y C.元素第一電離能:Z<W D.簡單氫化物的沸點:X<Z 組卷:183引用:9難度:0.5 -
6.如圖是某種偶氮苯X和Y的結構簡式,有關說法正確的是( )

A.X與Y互為同分異構體 B.Y的化學式為C28H38O10N2 C.X分子中C均為sp2雜化 D.X與Y互為同系物 組卷:39引用:3難度:0.6
二、解答題(共5小題,滿分58分)
-
18.一種以廢舊鎳氫電池[含Ni(OH)2、NiOOH、Co、Co(OH)2等]為原料,制取Ni/C納米復合材料同時獲得鈷氧化物的工藝流程圖如圖:
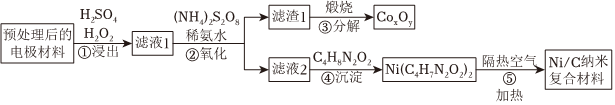
已知:ⅰ.Ni在水溶液中通常只以Ni2+的形式存在。
ⅱ.常溫下有關氫氧化物開始沉淀和沉淀完全的pH如下表:
ⅲ.在溶液中存在氨的條件下,C4H8N2O2可轉化為C4H7N2氫氧化物 Co(OH)3 Co(OH)2 Ni(OH)2 開始沉淀的pH / 7.1 7.7 沉淀完全的pH 1.1 9.1 9.2 ,C4H7N2O-2是一種優良的配體。O-2
(1)浸出過程中能加快反應速率的措施有(至少寫出兩種)。
(2)浸出過程中H2O2與NiOOH反應的離子方程式是。
研究表明H2O2用量為5mL/g時,H2SO4濃度與鎳、鈷浸出率關系如圖所示: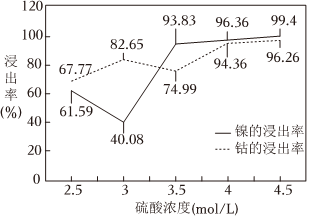
鎳、鈷浸出過程中H2SO4最佳濃度為mol/L。
(3)濾液1中加入(NH4)2S2O8的目的是;用氨水調節pH至5~7的目的是。
(4)濾液2中加入C4H8N2O2的作用有:沉淀Ni2+、、。
(5)取濾渣1的煅燒產物2.41g溶于100mL鹽酸(此時溶液中Co以Co2+形式存在),用火焰原子吸收光譜法測得該溶液中Co2+濃度為0.3mol/L,則CoxOy化學式是。組卷:12引用:1難度:0.6 -
19.實驗小組同學為探究Fe2+性質,進行如下實驗。
【實驗Ⅰ】向2mL0.1mol?L-1FeSO4溶液滴中幾滴0.1mol?L-1KSCN溶液,無明顯現象,再滴加幾滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液顏色變紅。
(1)甲同學通過上述實驗分析Fe2+具有(填“氧化”或“還原”)性。
乙同學查閱資料發現Fe2+與SCN可發生反應,生成無色的配合物。為證實該性質,利用FeCO3進行如下實驗。
(2)FeCO3的制備:用過量NH4HCO3溶液與FeSO4溶液反應得到FeCO3,離子方程式為。
【實驗Ⅱ】驗證Fe2+與SCN-發生反應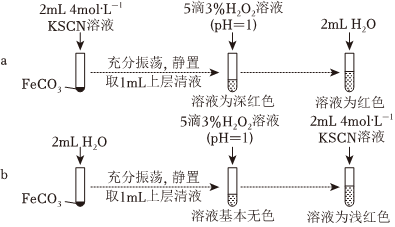
(3)通過實驗b排除了的干擾。
(4)從沉淀溶解平衡角度解釋實驗a和b最終溶液顏色不同的原因是。丙同學設計實驗進一步證明Fe2+可與SCN-反應。
【實驗Ⅲ】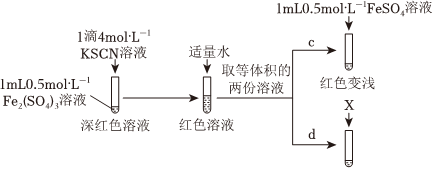
(5)上述實驗中,d為c的對照實驗。
①X為。
②實驗能夠證實Fe2+可與SCN-反應,則應觀察到的現象是。
(6)實驗Ⅲ中若未加適量水稀釋,則無法通過現象得出結論。推測加水稀釋的目的可能有:使后續實驗顏色變化易于觀察;降低c(Fe3+),。組卷:20引用:2難度:0.6


