2021-2022學年廣東省梅州市興寧市葉塘中學高二(上)期中化學試卷
發布:2024/12/19 22:0:1
一、單選題(共16小題,共48分)
-
1.下列表示的是有機化合物結構式中的一部分,其中不是官能團的是( )
A.-OH B.-C≡C- C. 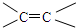
D.C-C 組卷:40引用:3難度:0.9 -
2.下列過程不屬于化學變化的是( )
A.在蛋白質溶液中,加入飽和硫酸銨溶液,有沉淀析出 B.皮膚不慎沾上濃硝酸而呈現黃色 C.在蛋白質溶液中,加入硫酸銅溶液,有沉淀析出 D.用稀釋的福爾馬林溶液浸泡植物種子 組卷:42引用:5難度:0.9 -
3.下列變化中,由加成反應引起的是( )
A.乙烯通入酸性高錳酸鉀溶液中,高錳酸鉀溶液褪色 B.苯在一定溫度、壓強和催化劑的作用下和氫氣反應,生成環己烷 C.一定條件下,苯滴入濃硝酸和濃硫酸的混合液中,有油狀物生成 D.苯加入到溴水中,振蕩后溴水層褪色 組卷:33引用:7難度:0.9 -
4.下列有機物分子中,所有原子不可能在同一平面內的是( )
A.CH2═CHCl B.CH3CH2CH3 C. 
D.CF2═CF2 組卷:5引用:1難度:0.7 -
5.以下化學用語不正確的是( )
A.乙醇的空間充填模型如圖 
B.乙醇的分子式為C2H6O C.乙醇的結構簡式為C2H5OH D.羥基的電子式為  組卷:16引用:1難度:0.8
組卷:16引用:1難度:0.8 -
6.甲烷是一種高效清潔的新能源,0.25mol甲烷完全燃燒生成液態水時放出222.5kJ熱量,則下列表示甲烷燃燒熱的熱化學方程式中正確的是( )
A.2CH4+4O2═2CO2+4H2O△H=+890kJ/mol B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890kJ/mol C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780kJ/mol 組卷:29引用:4難度:0.6 -
7.下列屬于吸熱反應的是( )
A.氣態水液化為液態水 B.高溫分解石灰石 C.氫氧化鈉和鹽酸反應 D.氫氣在氯氣中燃燒 組卷:74引用:4難度:0.7
二、非選擇題(共5題,共52分)
-
20.(1)在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子稱為活化分子,使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用kJ/mol表示。請認真觀察圖示,然后回答問題:

①圖中所示反應是(填“吸熱”或“放熱”)反應,該反應的△H=(用含E1、E2的代數式表示)。
②由上圖可知曲線Ⅱ較曲線Ⅰ低,這是由于。
(2)甲醇既是重要的化工原料,又可作為燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,發生的主要反應如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反應①中相關的化學鍵鍵能數據如下:
由此計算△H1=化學鍵 H-H C-O C≡O H-O C-H E/kJ?mol-1 436 343 1076 465 413 kJ?mol-1;已知△H2=-58 kJ?mol-1,則△H3=kJ?mol-1。組卷:13引用:2難度:0.5 -
21.化學反應伴隨能量變化,獲取反應能量變化有多條途徑。
(1)下列反應中,屬于放熱反應的是( 填字母)。
A.碳與水蒸氣反應
B.鋁和氧化鐵反應
C.CaCO3受熱分解
D.鋅與鹽酸反應
(2)獲取能量變化的途徑
①通過化學鍵的鍵能計算。已知:
計算可得:2H2(g)+O2(g)═2H2O(g)△H=化學鍵種類 H-H O=O O-H 鍵能(kJ/mol) 436 496 463.4 。
②通過物質所含能量計算。已知反應中M+N=P+Q中M、N、P、Q所含能量依次可表示為EM、EN、EP、EQ,該反應△H=。
③通過蓋斯定律可計算。已知在25℃、101kPa時:
Ⅰ.2Na(s)+O2(g)═Na2O(s)△H=-412kJ?mol-112
Ⅱ.2Na(s)+O2(g)═Na2O2(s)△H=-511kJ?mol-1
寫出Na2O2與Na反應生成Na2O的熱化學方程式。
④利用實驗裝置測量鹽酸與NaOH溶液反應的熱量變化的過程中,若取50mL 0.50mol?L-1的鹽酸,則還需加(填序號)。
A.1.0g NaOH固體
B.50mL 0.50mol?L-1NaOH溶液
C.50mL 0.55mol?L-1NaOH溶液組卷:54引用:3難度:0.5


