2021-2022學年黑龍江省綏化一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(60分)
-
1.化學與生產、生活關系密切,下列做法與調控化學反應速率無關的是( )
A.用煤粉代替煤塊 B.向門窗合頁里注油 C.將聚餐打包的食物放入冰箱中 D.實驗室制氫氣時,用粗鋅代替純鋅 組卷:15引用:1難度:0.7 -
2.表中物質的分類組合完全正確的是( )
選項 A B C D 強電解質 KNO3 H2SO4 BaSO4 HClO4 弱電解質 CH3COONa CaCO3 H2CO3 NH3?H2O 非電解質 SO2 CS2 H2O C2H5OH A.A B.B C.C D.D 組卷:81引用:2難度:0.8 -
3.50mL 0.50mol?L-1鹽酸與50mL 0.55mol?L-1 NaOH溶液進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,下列說法錯誤的是( )
A.在測定中和熱的實驗中,至少需要測定并記錄的溫度是3次 B.環形玻璃攪拌棒材料若用銅代替,則測得的△H會偏大 C.用相同濃度、相同體積的醋酸溶液代替鹽酸進行上述實驗,測得的△H會偏大 D.測量鹽酸的溫度后,必須用水將溫度計洗凈后再測量NaOH溶液的溫度 組卷:48引用:3難度:0.7 -
4.關于中和熱,下列說法正確的是( )
A.在稀溶液中,任何酸與堿發生中和反應生成1molH2O(l)時放出的熱量均為 57.3kJ。該反應的逆反應為吸熱反應,升高溫度可提高活化分子的百分數 B.測定中和熱過程中,實驗前用溫度計測量NaOH溶液的溫度后,立刻測定鹽酸的溫度 C. H2SO4(aq)+12Ba(OH)2(aq)═12BaSO4(s)+H2O(l),該反應△H=-57.3kJ/mol12D.中和熱的測定實驗中,可選擇50mL0.5mol/L稀鹽酸和50mL0.55mol/LNaOH溶液進行實驗 組卷:145引用:1難度:0.4 -
5.下列說法中正確的是( )
A.熱化學方程式未注明溫度和壓強時,ΔH表示標準狀況下的數據 B.1molH2SO4 和1molBa(OH)2 完全反應所放出的熱量稱為中和熱 C.在101kPa 時,1mol碳燃燒放出的熱量就是碳的燃燒熱 D.任何化學反應都伴隨著能量的變化 組卷:1引用:1難度:0.5 -
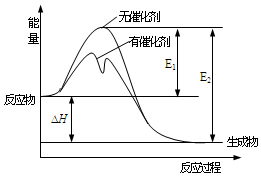 6.2SO2(g)+O2(g)?2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是( )
6.2SO2(g)+O2(g)?2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是( )A.該反應的逆反應為吸熱反應,升高溫度可提高活化分子的百分數 B.500℃、101kPa下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應生成SO3(g)放熱akJ,其熱化學方程式為2SO2(g)+O2(g)?2SO3(g)△H=-2a kJ?mol-l C.該反應中,反應物的總鍵能小于生成物的總鍵能 D.△H=E1-E2,使用催化劑改變活化能,但不改變反應熱 組卷:134引用:18難度:0.6 -
7.下列四幅圖示所表示的信息與對應的敘述相符的是( )
A. 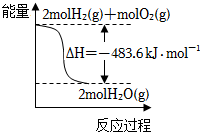
圖表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為241.8kJ?mol-1B. 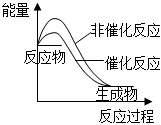
圖表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化C. 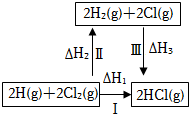
圖表示一定條件下H2和Cl2生產HCl的反應熱與途徑無關,則△H1=△H2+△H3D. 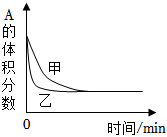
圖表示壓強對可逆反應2A(g)+2B(g)?3C(g)+D(s)的影響,乙的壓強大組卷:59引用:14難度:0.6 -
8.以下幾個熱化學方程式中能表示燃燒熱的是( )
A.C(s)+ O2(g)═CO(g)△H=-110.5kJ?mol-112B.C8H18(1)+ O2(g)═8CO2(g)+9H2O(l)△H=-5518kJ?mol-1252C.2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ?mol-1 D.H2(g)+ O2(g)═H2O(g)△H=-241.8kJ?mol-112組卷:53引用:4難度:0.7 -
9.研究表明N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如下圖所下列說法錯誤的是( )
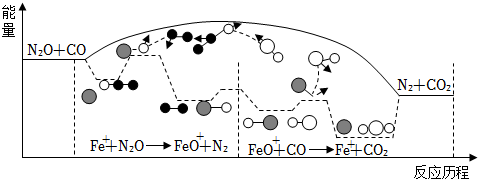
A.N2O與CO反應的△H<0 B.FeO+也是該反應的催化劑 C.Fe+使該反應的活化能減小 D.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2兩步反應均為放熱反應 組卷:24引用:6難度:0.9 -
10.下列有關化學反應速率和限度的說法中,錯誤的是( )
A.“新冠疫苗”一般應冷藏存放,可降低蛋白質變性的反應速率 B.2SO2(g)+O2(g)?2SO3(g)反應中加入18O2,達到平衡后SO2中不可能有18O C.實驗室用H2O2分解制O2,加入MnO2作催化劑后,反應速率明顯加快 D.化學反應的限度決定了反應物在該條件下的最大轉化率 組卷:206引用:2難度:0.3 -
11.在一定溫度下,某密閉容器中發生反應:2C(g)?A(g)+B(s)ΔH>0,若 0~15s 內 c(C)由0.1mol?L-1降到0.07mol?L-1,則下列說法正確的是( )
A.0~15s內用 B 表示的平均反應速率為 v(B)=0.001mol?L-1?s-1 B.c(C)由0.07mol?L-1 降到0.05mol?L-1所需的反應時間小于10s C.升高溫度正反應速率加快,逆反應速率減慢 D.減小反應體系的體積,化學反應速率加快 組卷:9引用:1難度:0.7
二、非選擇題)(共40分)
-
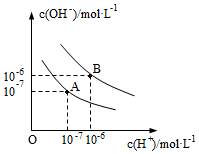 32.已知水在 25℃和 100℃時的電離平衡曲線如圖所示。
32.已知水在 25℃和 100℃時的電離平衡曲線如圖所示。
(1)25℃時水的電離平衡曲線應為(填“A”或“B”)。其理由是。
(2)25℃時,將 pH=9 的 NaOH 溶液與 pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則 NaOH溶液與 H2SO4溶液的體積比為。
(3)25℃時,等體積的pH=12的NaOH和氨水溶液與0.1mol/L的鹽酸發生中和反應時,恰好完全反應時消耗鹽酸的體積。(填:前者多,后者多,一樣多)
(4)100℃時,由水電離出H+的濃度為10-11mol/L,則該溶液中一定能大量共存的是。
A.K+、Cl-、NO3-、S2-
B.K+、Fe2+、I-、SO42-
C.Na+、SO42-、NO3-、Cl-
D.OH-、NH4+、HCO3-、Na+組卷:10引用:1難度:0.6 -
33.碳和氮的化合物是廣泛的化工原料,回答下列問題:
I.在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g),其化學平衡常數 K 和溫度 t 的關系如表:回答下列問題:
(1)該反應為t℃ 700 800 830 1000 12000 K 0.6 0.9 1.0 1.7 2.6 反應(填“吸熱”、“放熱”)。
(2)某溫度下,平衡濃度符合下式:3c(CO2)?c(H2)=5c(CO)?c(H2O),試判斷此時的溫度為℃。
(3)在800℃時,發生上述反應,某一時刻測得容器內各物質的濃度分別為c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,則下一時刻,v 正v逆(填“>”、“<”或“=”)。
(4)反應達平衡后,向容器中通入與平衡混合氣組成、比例相同的氣體,達到新平衡時與原平衡相比,有 關說法正確的是。
A.反應物轉化率增大
B.逆反應速率增大
C.各物質的比例不變
D.c(CO2)增大、c(CO)減小
Ⅱ.NO2 的二聚體 N2O4 是火箭中常用氧化劑。完成下列問題。
(5)在 1000K 下,在某恒容容器中發生下列反應:2NO2(g)?2NO(g)+O2(g),將一定量的 NO2 放入恒容密閉容器中,測得其平衡轉化率α(NO2)隨溫度變化如圖所示。圖中 a 點對應溫度下,已知 NO2 的起始壓強P0 為 120KPa,列式計算該溫度下反應的平衡常數 Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。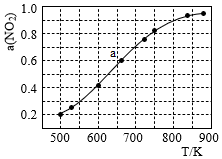 組卷:8引用:1難度:0.5
組卷:8引用:1難度:0.5


