2020年北京市海淀區高考化學二模試卷
發布:2024/4/20 14:35:0
一、第一部分選擇題本部分共14題,每題3分,共42分.在每題列出的四個選項中,選出最符合題目要求的一項.
-
1.下列資源利用過程中,不涉及化學變化的是( )




A.石油分餾 B.煤的干餾 C.發酵法制沼氣 D.海水提鎂 A.A B.B C.C D.D 組卷:41引用:2難度:0.8 -
2.利用化學方法可以改善大氣質量、進行水處理等。下列說法不正確的是( )
A.減少化石燃料的燃燒有益于緩解溫室效應 B.向天然水中加入明礬可起到殺菌消毒的作用 C.可用熟石灰處理鋼鐵廠、電鍍廠產生的酸性廢水 D.在汽車尾氣系統中安裝催化轉化器可減少尾氣污染 組卷:50引用:2難度:0.6 -
3.下列物質混合后,能產生藍色沉淀的是( )
A.FeCl3溶液與NaOH溶液 B.FeSO4溶液與K3[Fe(CN)6]溶液 C.AgNO3溶液與氨水 D.雞蛋清與濃硝酸 組卷:130引用:1難度:0.8 -
4.2019年,我國青年化學家雷曉光被遴選為“青年化學家元素周期表”氮元素的代言人。下列與氮元素有關的說法正確的是( )
A.14N與14C互為同位素 B.-NH2的電子式為 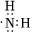
C.NH3的熱穩定性比HF的強 D.Si3N4中N為+3價 組卷:57引用:3難度:0.8 -
5.下列實驗操作能達成實驗目的且涉及到氧化還原反應的是( )
選項 實驗目的 實驗操作 A 除去CO2中的SO2 先后通過盛有酸性KMnO4溶液、濃硫酸的洗氣瓶 B 除去MgCl2溶液中的AlCl3 加入過量NaOH溶液,過濾,向沉淀中加入適量鹽酸 C 檢驗溶液中含有Fe3+ 加入KSCN溶液 D 檢驗稀硫酸催化淀粉水解的產物為葡萄糖 向水解后的溶液中直接加入新制Cu(OH)2,加熱 A.A B.B C.C D.D 組卷:46引用:2難度:0.5 -
 6.芹菜中的芹黃素具有抗腫瘤、抗病毒等生物學活性,其熔點為347℃~348℃,結構簡式如圖所示。下列關于芹黃素的說法不正確的是( )
6.芹菜中的芹黃素具有抗腫瘤、抗病毒等生物學活性,其熔點為347℃~348℃,結構簡式如圖所示。下列關于芹黃素的說法不正確的是( )A.常溫下為固體,需密封保存 B.分子中含有3種含氧官能團 C.與溴水只發生加成反應 D.1mol芹黃素最多能與3mol NaOH反應 組卷:76引用:5難度:0.5
二、第二部分本部分共5題,共58分.
-
18.H2S是一種大氣污染物。工業尾氣中含有H2S,會造成嚴重的環境污染;未脫除H2S的煤氣,運輸過程中還會腐蝕管道。
(1)干法氧化鐵脫硫是目前除去煤氣中H2S的常用方法,其原理如圖1所示。
①下列說法正確的是(填序號)。
a.單質硫為黃色固體
b.脫硫反應為3H2S+Fe2O3?H2O=Fe2S3?H2O+3H2O
c.再生過程中,硫元素被還原
d.脫硫過程中,增大反應物的接觸面積可提高脫硫效率
②從安全環保的角度考慮,再生過程需控制反應溫度不能過高的原因是。
(2)電化學溶解一沉淀法是一種回收利用H2S的新方法,其工藝原理如圖2所示。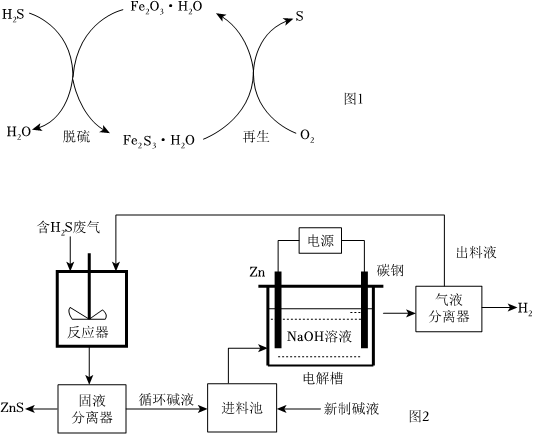
已知:Zn與強酸、強堿都能反應生成H2;Zn(Ⅱ)在過量的強堿溶液中以[Zn(OH)4]2-形式存在。
①鋅棒連接直流電源的(填“正極”或“負極”)。
②反應器中反應的離子方程式為。
③電解槽中,沒接通電源時已經有H2產生,用化學用語解釋原因:。
(3)常用碘量法測定煤氣中H2S的含量,其實驗過程如下:
i.將10L煤氣通入盛有100mL鋅氨絡合液的洗氣瓶中,將其中的H2S全部轉化為ZnS沉淀,過濾;
ii.將帶有沉淀的濾紙加入盛有15mL 0.1mol/L碘標準液、200mL水和10mL鹽酸的碘量瓶中,蓋上瓶塞,搖動碘量瓶至瓶內濾紙搖碎,置于暗處反應10 min后,用少量水沖洗瓶壁和瓶塞。(已知:ZnS+I2═ZnI2+S)
iii.用0.1mol/L Na2S2O3標準液滴定,待溶液呈淡黃色時,加入1mL淀粉指示劑,繼續滴定至終點。(已知:2Na2S2O3+I2═Na2S4O6+2NaI)
①i中,將煤氣中的H2S轉化為ZnS的目的是。
②滴定終點的現象是。
③若消耗Na2S2O3標準液的體積為20mL,則煤氣中H2S的含量為mg/m3組卷:104引用:3難度:0.5 -
19.工業上用Cu(NH3)4SO4和氨水的混合液浸取廢銅礦渣中的單質銅,得到[Cu(NH3)2]2SO4.某小組同學欲通過實驗探究其原理。
【查閱資料】i.[Cu(NH3)4]2+呈深藍色,[Cu(NH3)4]2+?Cu2++4NH3;受熱易分解,放出氨氣。
ii.Cu+在水溶液中不穩定,Cu(I)在溶液中只能以[Cu(NH3)2]+等絡合離子的形式穩定存在;[Cu(NH3)2]+無色,易被氧氣氧化為[Cu(NH3)4]2+。
【實驗1】制備Cu(NH3)4SO4。
向盛有2mL 0.1mol/L CuSO4溶液的試管中滴加2mL 1mol/L氨水,觀察到溶液中立即出現淺藍色沉淀;隨后沉淀逐漸溶解,得到深藍色溶液。經分離得到Cu(NH3)4SO4晶體。
(1)資料表明,向CuSO4溶液中滴加氨水,可能會生成淺藍色Cu2(OH)2SO4沉淀。
①該小組同學取實驗1中淺藍色沉淀,洗滌后,(補全實驗操作和現象),證明沉淀中含有。SO2-4
②補全實驗1中生成Cu2(OH)2SO4沉淀的離子方程式:2Cu2+++═Cu2(OH)2SO4↓+SO2-4。
(2)甲同學設計實驗證明深藍色溶液中含Cu(NH3)4SO4:加熱深藍色溶液并檢驗逸出氣體為氨氣。你認為此方案(填“可行”或“不可行”),理由是。
【實驗2】探究用Cu(NH3)4SO4和氨水的混合液浸取單質銅得到[Cu(NH3)2]2SO4的原理。
已知:其他條件相同時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,檢測到的電壓越大編號 實驗裝置及部分操作 燒杯中溶液 實驗現象 2-1 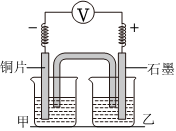
實驗開始,先讀取電壓表示數,后迅速將其換成電流表,繼續實驗,10 min內記錄甲燒杯中現象甲:0.05mol/LNa2SO4
乙:0.05mol/LCu(NH3)4SO4電壓表指針迅速偏轉至0.1V;甲中溶液無明顯變化 2-2 甲:0.05mol/LNa2SO4
乙:0.05mol/LCuSO4電壓表指針迅速偏轉至0.3V;甲中溶液無明顯變化 2-3 甲:0.1mol/LNa2SO4與1mol/L氨水等體積混合
乙:溶液A電壓表指針迅速偏轉至0.35V;甲中溶液無明顯變化 2-4 甲:0.1mol/LNa2SO4與1mol/L氨水等體積混合
乙:0.05mol/LCuSO4電壓表指針迅速偏轉至0.65V;幾分鐘后,甲燒杯溶液逐漸由無色變藍色
(3)溶液A為。
(4)對比實驗2-1和2-2,可以得到結論是。
(5)實驗2-4中,甲燒杯中溶液由無色變為藍色的原因是。
(6)依據上述實驗,分析用Cu(NH3)4SO4和氨水的混合液浸取單質銅的原理:。組卷:84引用:2難度:0.5


