2023-2024學年遼寧省大連八中高三(上)期中化學試卷
發布:2024/10/12 10:0:1
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.用來解釋下列事實的方程式正確的是( )
A.用濃鹽酸與MnO2反應制取氯氣:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O△B.鋼鐵發生吸氧腐蝕的負極反應:Fe-3e-═Fe3+ C.用銅作電極電解飽和食鹽水:2Cl-+2H2O 2OH-+H2↑+Cl2↑電解D.過氧化鈉用作供氧劑:Na2O2+CO2═Na2CO3+O2 組卷:8引用:1難度:0.7 -
2.恒溫恒容密閉容器中,一定條件發生下列反應,有關說法正確的是( )
A.反應SiO2+2C Si+2CO↑高溫下才能自發進行,則該反應的ΔH>0高溫B.反應CaCO3(s) CaO(s)+CO2(g)達平衡后,向該容器中充入少量CO2,反應再次達平衡時,c(CO2)增大高溫C.可逆反應NH2COONH4(s) 2NH3(g)+CO2(g),當NH3的體積分數不變時,標志著該反應達到平衡狀態△D.反應2SO3(g)?2SO2(g)+O2(g)達平衡后,向該容器中再充入少量SO3,此時正反應速率增大,是因為反應物中活化分子百分數增大 組卷:14引用:1難度:0.5 -
3.25℃時,下列有關電解質溶液的說法正確的是( )
A.0.1mol/LNaHCO3溶液中: c(Na+)=c(HCO-3)+c(CO2-3)B.將CH3COONa溶液從25℃升溫至60℃,溶液中 增大c(CH3COO-)c(CH3COOH)?c(OH-)C.pH相同的①CH3COONa、②NaOH、③NaClO三種溶液中c(Na+):③>①>② D.物質的量濃度相同的①NH4Cl溶液②NH4HCO3溶液, :①>②c(NH+4)組卷:101引用:2難度:0.5 -
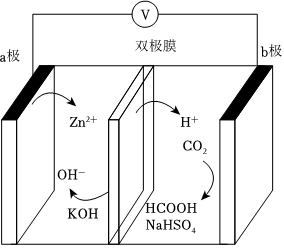 4.可充電水系Zn-CO2電池用鋅和催化劑材料作兩極,電池工作示意圖如圖所示,其中雙極膜是由陽膜和陰膜制成的復合膜,在直流電場的作用下,雙極膜復合層間的H2O電離出的H+和OH-可以分別通過膜移向兩極。下列說法正確的是( )
4.可充電水系Zn-CO2電池用鋅和催化劑材料作兩極,電池工作示意圖如圖所示,其中雙極膜是由陽膜和陰膜制成的復合膜,在直流電場的作用下,雙極膜復合層間的H2O電離出的H+和OH-可以分別通過膜移向兩極。下列說法正確的是( )A.溶液的pH:0.1mol?L-1HCOOH>0.01mol?L-1HCOOH B.放電時,電極a為負極,發生還原反應 C.放電時,若電路中通過1mol電子,理論上消耗0.5molCO2 D.充電時,雙極膜中水電離出的H向b極移動 組卷:25引用:1難度:0.6 -
5.下列離子組中加(或通)入相應試劑后,判斷和分析均正確的是( )
離子組 加(或通)入試劑 判斷和分析 A 、Fe2+、NH+4SO2-4足量Ba(OH)2溶液 不能大量共存,因發生下列反應
2+NH+4+2OH-═BaSO4↓+2NH3?H2OSO2-4B Ba2+、Na+、H+、Cl-、 NO-3足量CO2 能大量共存 C Na+、K+、 、Cl-AlO-2足量NaHCO3溶液 不能大量共存,因 和AlO-2之間會發生相互促進的水解生成CO2氣體和Al(OH)3沉淀HCO-3D Na+、K+、ClO-、 SO2-4少量SO2 不能大量共存,只發生下列氧化還原反應ClO-+H2O+SO2═Cl-+ +2H+SO2-4A.A B.B C.C D.D 組卷:11引用:1難度:0.6 -
6.已知ROH(R=Na、K)固體溶于水放熱,有關過程能量變化如圖( )
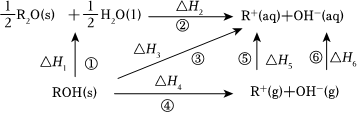
A.反應①:ΔH1<0,ΔS<0 B.ΔH4(NaOH<ΔH4(KOH) C.ΔH3>ΔH2 D.ΔH4=ΔH1+ΔH2+ΔH5+ΔH6 組卷:11引用:1難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.亞氯酸鈉(NaClO2)和ClO2都是重要的漂白劑。
(1)自來水廠用碘量法檢測水中ClO2的濃度,其實驗操作如下:
取100mL的水樣加稀硫酸調節pH至1~3,加入一定量的碘化鉀溶液,振蕩,再加入少量指示劑后,用1.0×10-4mol?L-1的Na2S2O3溶液滴定(已知:2S2+I2═S4O2-3+2I-)。O2-6
①加入的指示劑是,達到滴定終點時的現象是;
②已知滴定終點時,消耗Na2S2O3溶液16.30mL,則水樣中ClO2的濃度是mol?L-1。
(2)亞氯酸鈉(NaClO2)是一種應用廣泛的高效氧化型漂白劑。以下是某小組模擬工業制法利用ClO2與H2O2在堿性條件下制備少量NaClO2的實驗裝置: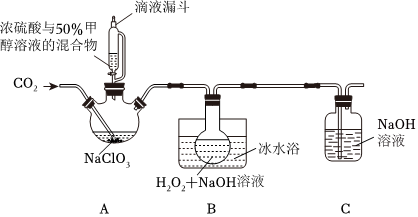
已知:
①硫酸作酸化劑時,甲醇(CH3OH)可將NaClO3還原為ClO2。
②飽和NaClO2溶液在溫度低于38℃時析出晶體NaClO2?3H2O,在溫度高于38℃時析出晶體NaClO2,高于60℃時分解生成NaClO3和NaCl。
回答下列問題:
(Ⅰ)裝置B中生成NaClO2的化學方程式是。
(Ⅱ)從反應后的B溶液中制得NaClO2晶體的操作步驟是:
a.控制在38~60℃之間蒸發濃縮、結晶;
b.;
c.用38~60℃的熱水洗滌;
d.在低于60℃的真空中蒸發,干燥。組卷:15引用:1難度:0.4 -
19.以CO2、H2為原料合成CH3OH涉及的反應如下:
I.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49kJ?mol-1
II.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41kJ?mol-1
I.CO(g)+2H2(g)?CH3OH(g)ΔH3
回答下列問題:
(1)Kp為分壓平衡常數,各反應的lnKp隨的變化如圖所示。計算反應III的ΔH3=1TkJ?mol-1,其對應的曲線為(填“a”或“c”)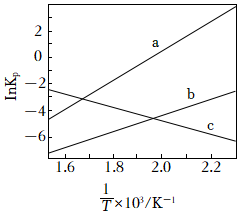
(2)在5MPa下,按照n(CO2):n(H2)=1:3投料,平衡時,CO和CH3OH在含碳產物中物質的量分數及CO2的轉化率隨溫度的變化如圖: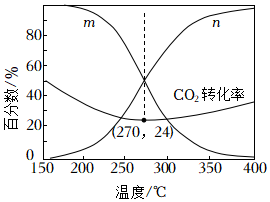
①圖中代表CH3OH的曲線為(填“m”或“n”)。
②解釋150~250℃范圍內CO2轉化率隨溫度升高而降低的原因。
③下列說法錯誤的是(填字母)。
A.H2的平衡轉化率始終低于CO2的
B.溫度越低,越有利于工業生產CH3OH
C.加入選擇性高的催化劑,可提高CH3OH的平衡轉化率
D.150~400℃范圍內,溫度升高,H2O的平衡產量先減小后增大
④270°C時CO的分壓為,反應II的平衡常數為(列出算式)。組卷:100引用:4難度:0.6


