2020-2021學年湖北省新高考聯考協作體高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中。只有一項是符合題目要求的。
-
1.下列說法正確的是( )
A.向雞蛋清溶液中加入濃的硫酸鈉溶液或福爾馬林,蛋白質均會變性 B.淀粉溶液中加入硫酸,加熱5分鐘,再加入少量銀氨溶液,加熱,有光亮的銀鏡生成 C.黃酒中某些微生物使乙醇氧化為乙酸,于是酒就變酸了 D.乙烯和聚氯乙烯都能發生加成反應 組卷:42引用:1難度:0.9 -
2.用NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.16.25gFeCl3水解形成的Fe(OH)3膠體粒子數為0.1NA B.1molC9H20中含有共價鍵數目為28NA C.標準狀況下,448mL二氯甲烷中含有分子數為0.02NA D.n(H2SO3)和n(HSO3-)之和為1mol的KHSO3溶液中,含有K+數目為NA 組卷:9引用:1難度:0.6 -
3.下列敘述錯誤的是( )
①熱穩定性:H2O>HF>H2S
②最外層兩個電子的元素不一定在第ⅡA族
③NaHSO4晶體溶于水時,離子鍵被破壞,共價鍵不受影響
④元素周期表中從ⅢB族到ⅡB族10個縱行的元素都是金屬元素
⑤金剛石和石墨互為同素異形體,熔點和硬度都很高
⑥氯的各種含氧酸的酸性由弱到強排列為HClO<HClO2<HClO3<HClO4
⑦兩個非金屬元素原子間只可能形成共價鍵,而含金屬元素的化合物中一定含離子鍵A.②④⑥⑦ B.①⑤⑥⑦ C.②③④⑤ D.①③⑤⑦ 組卷:24引用:1難度:0.8 -
4.下列實驗操作或裝置正確的是( )
A. 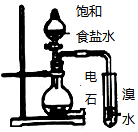
利用如圖所示裝置證明了乙炔能使溴水褪色B. 
利用如圖所示裝置制取乙烯C. 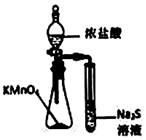
利用如圖所示裝置可以比較KMnO4、Cl2、S的氧化性D. 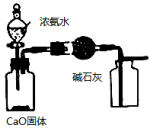
利用如圖所示裝置制取并收集干燥純凈的NH3組卷:2引用:1難度:0.5 -
5.下列離子方程式書寫正確的是( )
A.向硫酸鋁溶液中滴加碳酸鈉溶液:2Al3++3CO32-═Al2(CO3)3↓ B.向KI與稀硫酸的混合溶液中通入氧氣:4H++O2+6I-═3I2+2H2O C.已知還原性Fe2+>Br-,amolFeBr2溶液中通入amolCl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- D.在澄清石灰水中加入過量的碳酸氫鈉溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O 組卷:33引用:2難度:0.7 -
6.下面關于四種微粒的比較正確的是( )
①基態原子的電子排布式:1s22s22p63s23p4;
②價電子排布式:3s23p3;
③2p軌道為半充滿的原子;
④原子的2p軌道上只有兩對成對電子A.原子半徑:②>①>③>④ B.最高正化合價:④>①>③=② C.電負性:④>③>②>① D.第一電離能:④>③>①>② 組卷:99引用:3難度:0.7
二、非選擇題:本題共5小題,共55分。
-
 19.25℃時,部分物質的電離平衡常數如表所示:
19.25℃時,部分物質的電離平衡常數如表所示:
請回答下列問題:化學式 CH3COOH NH3?H2O H2CO3 H2SO3 H2S 電離平衡常數 1.7×10-5 1.7×10-5 K1=4.3×10-7
K2═5.6×10-11K1=1.3×10-2
K2═6.3×10-4K1=1.3×10-7
K2═7.1×10-15
(1)25℃時,0.1mol?L-1的(NH4)2S溶液呈。(填“酸性”、“堿性”或“中性”)
(2)用足量Na2CO3溶液吸收工業尾氣中少量SO2氣體,發生反應的離子方程式為。
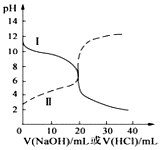
(3)25℃時,取濃度均為0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分別用0.1000mol?L-1NaOH溶液、0.1000mol?L-1鹽酸進行中和滴定,滴定過程中溶液pH隨滴加溶液的體積變化關系如圖所示。下列說法錯誤的是
a.曲線Ⅰ,滴加溶液到10mL時:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
b.當NaOH溶液和鹽酸滴加至20.00mL時,曲線Ⅰ和Ⅱ剛好相交
c.曲線Ⅱ:滴加溶液到10.00mL時,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
d.在逐滴加入NaOH溶液或鹽酸至40.00mL的過程中,水的電離程度先增大后減小組卷:30引用:1難度:0.7 -
20.碳酸錳(MnCO3)是高性能磁性材料,廣泛用于電子工業,也用于化工、醫藥等行業。以某礦物加工過程中產生的濾渣(主要成分為MnO2、Fe2O3含少量SiO2)為原料制備MnCO3的流程如圖:
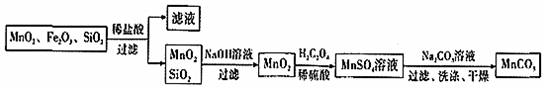
回答下列問題:
(1)錳、鐵在元素周期表中均屬于(填標號)。
a.短周期元素
b.第四周期元素
c.副族元素
d.過渡元素
(2)上述流程中的濾液經蒸干、灼燒可得到副產品,其化學式為。
(3)寫出MnO2轉化為MnSO4這一反應的離子方程式為。
(4)已知:25℃,Mn(OH)2的Ksp=1.9×10-13。若MnSO4溶液的濃度為1.9mol?L-1,制備MnCO3時為避免沉淀中混有Mn(OH)2,需控制溶液的pH不超過。
(5)MnSO4溶液和Na2CO3溶液混合產生MnCO3的沉淀,經過過濾、洗滌、干燥可獲得MnCO3過濾時需要用到的玻璃儀器有:燒杯、。請你簡述證明沉淀洗滌干凈的操作方法:。組卷:3引用:1難度:0.5


