2022年江蘇省揚州市大學附中中考化學模擬試卷
發布:2024/4/20 14:35:0
一、選擇恩(共20小題,每小題2分,滿分40分)
-
1.下列做法正確的是( )
A.燃放爆竹,增添氣氛 B.霉變大米,煮熟食用 C.深埋電池,消除污染 D.垃圾分類,資源再生 組卷:6引用:1難度:0.7 -
2.變化無處不在。生活中的下列現象是由化學變化引起的是( )
A.濕衣晾干 B.鐵鍋生銹 C.小麥磨粉 D.滴水成冰 組卷:186引用:21難度:0.8 -
3.下列物質由離子構成的是( )
A.氯化鈉 B.水 C.金剛石 D.空氣 組卷:9引用:1難度:0.6 -
4.物質分類是化學學習的常用方法。下列物質分類正確的是( )
A.單質:氮氣、空氣 B.酸:硝酸、檸檬酸 C.堿:氨水、硫酸銨 D.有機物:葡萄糖、碳酸氫銨 組卷:22引用:1難度:0.8 -
5.測得一些物質的pH如下,其中堿性最強的是( )
A.肥皂水:pH=10.2 B.唾液:pH=6.8 C.檸檬汁:pH=2.5 D.洗滌劑:pH=12.2 組卷:137引用:3難度:0.2 -
6.“安全重于泰山”。以下應張貼在“防火”場所的標志是( )
A. 
B. 
C. 
D.  組卷:171引用:15難度:0.9
組卷:171引用:15難度:0.9 -
7.物質X和Ba(OH)2在溶液中反應的化學方程式為:X+Ba(OH)2═BaSO4↓+2Y,下列說法正確的是( )
A.X可能為氯化鐵 B.X只能為硫酸 C.Y可以為氫氧化銅 D.Y不一定是水 組卷:782引用:10難度:0.5 -
8.下列對有關實驗異常現象分析的可能原因中,合理的是( )
A.測定空氣中氧氣含量時,進水量偏多--紅磷過量 B.做過濾實驗時,過濾速度過慢--沒有用玻璃棒在漏斗內進行攪拌 C.檢驗銨鹽時,紅色石蕊試紙較長時間未變色--試紙未先潤濕 D.給液體加熱的實驗結束后,發現試管破裂--試管內盛的液體超過了三分之一 組卷:196引用:2難度:0.7
二、填空題(本大題共8個小題,共60分)
-
24.硫酸亞鐵銨晶體[(NH4)2Fe(SO4)2?6H2O]是一種重要的工業原料,易溶于水,不溶于乙醇。將硫酸亞鐵溶液與硫酸銨溶液混合很容易制得硫酸亞鐵銨晶體。某班級分小組擬在實驗室制備硫酸亞鐵銨晶體。
已知:a.FeSO4在空氣中容易被氧化為Fe2(SO4)3;
b.含Fe3+的溶液中滴加硫氰化鉀(KSCN)溶液,溶液會呈現血紅色;含Fe2+的溶液中滴加硫氰化鉀溶液,無明顯現象。
c.相關物質的溶解度曲線如圖。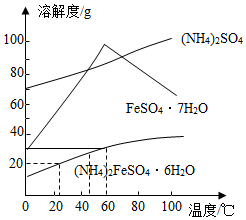
Ⅰ.甲小組設計了如圖流程制備硫酸亞鐵銨晶體: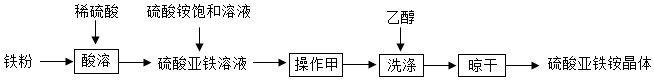
(1)“酸溶”反應的化學方程式是。
(2)“操作甲”應進行蒸發濃縮、冷卻結晶、趁熱過濾,此時“趁熱過濾”適宜的溫度約為。
(3)使用乙醇進行“洗滌”的優點有:①;②乙醇揮發性好,便于晾干。
Ⅱ.乙小組研究了相關資料后,設計如圖實驗裝置制備少量硫酸亞鐵銨晶體,實驗步驟為: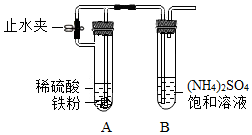
①按照圖示搭好實驗裝置,檢查裝置氣密性良好;
②先向B中加入一定量(NH4)2SO4飽和溶液,再向A的試管中加入一定量鐵粉,再迅速加入足量稀硫酸,塞好塞子,打開止水夾,B中溶液下的導管口有持續的氣泡冒出;
③一段時間后,關閉止水夾,A中的淺綠色溶液經由導管進入B中,B中出現淺藍綠色的硫酸亞鐵銨晶體。
(4)步驟②,將產生的氫氣向B中持續通入一段時間,其目的是。
(5)步驟③中,關閉止水夾后,A中的淺綠色溶液能夠進入B中的原因是。
Ⅲ.丙小組對硫酸亞鐵銨晶體進行組成檢驗
(6)為驗證所得產品中可能含有Fe3+,于是分別取甲、乙兩小組所得晶體少許,加蒸餾水溶解后,,證明甲小組所得硫酸亞鐵銨晶體含Fe3+;而乙小組的晶體溶液中沒有明顯現象。
(7)取乙小組所得晶體少許,加蒸餾水溶解后,分為兩份。
①取其中一份,,則證明晶體中含有NH4+;
②取另一份,加入少量稀鹽酸,無現象,再滴加BaCl2溶液,有白色沉淀生成,則可證明晶體中含有SO42-。組卷:159引用:2難度:0.3 -
25.軟磁鐵氧體是用量很大的一種磁性材料,也是電子信息和家電工業等的重要基礎功能性材料。Mn3O4是生產軟磁鐵氧體材料的主要原料,實驗室以SO2氣體制備少量高純Mn3O4的操作步驟如下:
【資料】①亞硫酸(H2SO3)在Mn2+催化作用下被O2氧化為硫酸,硫酸與MnO2在常溫下不易發生反應。
②MnSO4在空氣中高溫煅燒生成Mn3O4和SO3,當溫度超過1000℃時,Mn3O4易被氧化。
【步驟Ⅰ】制備MnSO4溶液:在三頸燒瓶中(裝置見圖1)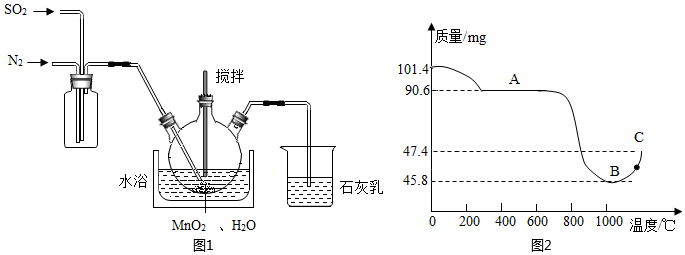
加入一定量MnO2和水,先通氮氣,再通入SO2和N2混合氣體,攪拌反應3小時。停止通SO2,繼續反應片刻后過濾得MnSO4溶液。
(1)燒杯中石灰乳(有效成分為氫氧化鈣)的作用為。
(2)三頸燒瓶中生成MnSO4的反應化學方程式為。
(3)步驟Ⅰ中,先通入氮氣的目的是。為使SO2盡可能轉化完全,在不改變固液投料比,且通入的SO2和N2比例一定的條件下,可采取的合理措施有:及時攪拌反應液、(任寫一條)。
【步驟Ⅱ】制備MnSO4?H2O晶體:利用硫酸錳的溶解度在100℃以上隨溫度升高而急劇降低的原理,用壓力釜升溫加壓結晶法后,過濾、洗滌、低溫干燥,得純凈的MnSO4?H2O晶體。
【步驟Ⅲ】制備Mn3O4固體:準確稱取101.4mg MnSO4?H2O,將MnSO4?H2O晶體在空氣中高溫煅燒,圖2是用熱重分析儀測定煅燒時溫度與剩余固體質量變化曲線。
(4)該曲線中A段所表示物質的化學式為。
(5)試通過計算確定反應至圖中C點時所對應的剩余固體成分的化學式。組卷:299引用:2難度:0.1


