2021-2022學年天津市河東區三校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共22題,每題3分,滿分66分)
-
1.下列設備工作時,將化學能轉化為熱能的是( )
A. 
硅太陽能電池B. 
鋰離子電池C. 
太陽能集熱器D. 
燃氣灶組卷:373引用:45難度:0.9 -
2.下列說法正確的是( )
A.已知2H2(g)+O2(g)═2H2O(g)ΔH=-483.6kJ/mol,則氫氣的燃燒熱為241.8kJ/mol B.已知2C(s)+2O2(g)═2CO2(g)ΔH=akJ/mol,2C(s)+O2(g)═2CO(g)ΔH=bkJ/mol,則a>b C.可燃物的系數為1的燃燒反應的焓變即為該可燃物的燃燒熱 D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) ΔH=-457.4kJ/mol,則含0.5mol NaOH的稀溶液與稀醋酸完全中和,放出的熱量小于228.7kJ 組卷:15引用:5難度:0.5 -
3.下列熱化學方程式中,正確的是( )
A.甲烷的燃燒熱ΔH=-890.3kJ/mol,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890.3kJ/mol B.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,H2燃燒的熱化學方程式表示為:2H2(g)+O2(g)═2H2O(l)ΔH=-571.6kJ/mol C.HCl和NaOH反應的中和熱ΔH=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ/mol D.500℃、30MPa下,已知熱化學方程式:N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ/mol,將1molN2(g)和3molH2(g)置于密閉容器中充分反應生成NH3(g),放熱38.6kJ 組卷:142引用:4難度:0.6 -
4.化學反應中一定伴隨著能量的變化,下列有關能量的說法正確的是( )
A.相同條件下,等物質的量的硫蒸氣和硫粉分別完全燃燒,前者放出熱量多 B.已知298K、101kPa條件下:4Al(s)+3O2(g)═2A12O3(s)ΔH=-2834.9kJ?mol-1,4Al(s)+2O3(g)═2A12O3(s)ΔH=-3119.1kJ?mol-1,則O3比O2穩定 C.根據熱化學方程式:S(s)+O2(g)═SO2(g)ΔH=-297.23kJ?mol-1,可推知1molSO2 (g)的能量總和大于1moS(s)和1molO2(g)的能量總和 D.在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1,將含0.5molH2SO4的濃硫酸與含1molNaOH的溶液混合時,放出的熱量小于57.3kJ 組卷:18引用:2難度:0.6 -
5.已知:HCN(aq)與NaOH(aq)反應的△H=-12.1kJ?mol-1;HCl(aq)與NaOH(aq)中和反應的△H=-55.6kJ?mol-1.則HCN在水溶液中電離的△H等于( )

A.+43.5kJ?mol-1 B.-43.5kJ?mol-1 C.-67.7kJ?mol-1 D.+67.7kJ?mol-1 組卷:121引用:28難度:0.9 -
 6.最近意大利羅馬大學的Fulvio Cacace等人獲得了極具理論研究意義的N4分子.N4分子結構如圖,已知斷裂1mol N-N吸收167kJ熱量,生成1molN≡N鍵放出942kJ熱量.根據以上信息和數據,則由N2氣體生成1mol氣態N4的ΔH為( )
6.最近意大利羅馬大學的Fulvio Cacace等人獲得了極具理論研究意義的N4分子.N4分子結構如圖,已知斷裂1mol N-N吸收167kJ熱量,生成1molN≡N鍵放出942kJ熱量.根據以上信息和數據,則由N2氣體生成1mol氣態N4的ΔH為( )A.+882 kJ/mol B.+441 kJ/mol C.-882 kJ/mol D.-441 kJ/mol 組卷:44引用:16難度:0.5 -
7.工業上制氫氣的一個重要反應是:CO(g)+H2O(g)?CO2(g)+H2(g)△H,
已知:C(石墨)+1/2 O2(g)=CO(g)△H1
H2(g)+1/2 O2(g)=H2O(g)△H2
C(石墨)+O2(g)=CO2(g)△H3
則下列說法正確的是( )A.△H<△H3 B.△H1<△H3 C.△H=△H3-△H2-△H1 D.△H=△H1+△H2-△H3 組卷:293引用:5難度:0.9 -
8.下列關于弱電解質的說法正確的是( )
A.弱電解質的相對強弱可由相同溫度下的電離常數值的大小來判斷 B.同一弱電解質,濃度越大,電離程度越大 C.升高溫度,弱電解質的電離程度減小 D.通常,電解質越弱,則其溶液的導電能力就越差 組卷:41引用:5難度:0.9
二、簡答題(共3題,滿分34分)
-
24.已知N2O4(g)?2NO2(g)ΔH>0,在80℃時,將0.4mol的四氧化二氮氣體充入2L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:
(1)20s時,N2O4的分解率是時間(s)
c(mol/L)0 20 40 60 80 100 c(N2O4) 0.20 a 0.10 c d e c(NO2) 0.00 0.12 b 0.22 0.22 0.22 。
(2)0~40s內N2O4的平均反應速率為。
(3)在80℃時該反應的平衡常數K值為(保留2位小數)。
(4)判斷t2、t3、t4時刻對該反應采取的措施。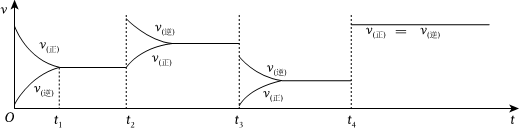
t2:;t3:;t4:。
(5)TiCl4(g)+O2(g)?TiO2(s)+2Cl2(g) ΔH1=-175.4kJ?mol-1
2C(s)+O2(g)?2CO(g) ΔH2=-220.9kJ?mol-1
TiCl4(g)與CO(g)反應生成TiO2(s)、C(s)和氯氣的熱化學方程式為。升高溫度對該反應的影響為。組卷:16引用:1難度:0.5 -
25.已知化學反應①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常數為K1,化學反應②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常數為K2,在溫度973K和1173K情況下,K1、K2的值分別如下:
請完成下列問題:溫度 K1 K2 973K 1.47 2.38 1173K 2.15 1.67
(1)通過表格中的數值可以推斷:反應①是(填“吸熱”或“放熱”)反應。
(2)現有反應③:CO2(g)+H2(g)?CO(g)+H2O(g),請你寫出該反應的平衡常數K3的表達式:K3=。
(3)在相同溫度下,根據反應①與②可推導出K3與K1、K2之間的關系式,據此關系式及上表數據,也能推斷出反應③是(填“吸熱”或“放熱”)反應。
(4)要使反應③在一定條件下建立的平衡向正反應方向移動,可采取的措施有(填寫字母序號,下同)。
A.增大壓強
B.體積不變時充入稀有氣體
C.升高溫度
D.使用合適的催化劑
(5)已知③的可逆反應CO(g)+H2O(g)?CO2(g)+H2(g),830K時,若起始時:c(CO)=2mol/L,c(H2O)=3mol/L,平衡時CO的轉化率為60%,水蒸氣的轉化率為;K的數值為。830K,若只將起始時c(H2O)改為6mol/L,則水蒸氣的轉化率為。組卷:144引用:2難度:0.3


