2021-2022學年浙江省臺州市十校聯盟高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本大題共25小題,每小題2分,共50分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.通過控制或改變反應條件可以加快、減緩甚至阻止反應的進行,使化學反應有利于人類的生存和提高生活質量。下列各圖所示的措施中,能加快化學反應速率的是( )
A. 
鐵門表面噴漆B. 
橡膠里加炭黑C. 
扇子扇煤爐火D. 
土壤稍稍烤焦組卷:30引用:8難度:0.7 -
2.在測定鹽酸與NaOH溶液反應的反應熱的實驗中,下列說法正確的是( )
A.使用環形玻璃攪拌棒是為了加快反應速率,減小實驗誤差 B.為了準確測定反應混合溶液的溫度,實驗中溫度計水銀球應與小燒杯底部接觸 C.用50mL的0.5mol?L-1NaOH溶液分別與50mL的0.5mol?L-1的鹽酸、醋酸溶液 反應,則測得的反應熱數值相同 D.在測定該反應熱實驗中需要使用的儀器有天平、量筒、燒杯、滴定管、溫度計 組卷:128引用:2難度:0.7 -
3.下列應用與鹽類水解無關的是( )
A.用Na2CO3溶液清洗油污 B.用明礬凈水 C.用TiCl4制備TiO2 D.加入鐵粉保存FeCl2溶液 組卷:13引用:1難度:0.8 -
4.下列化學用語表示正確的是( )
A.醋酸的電離:CH3COOH?CH2COOH-+H+ B.硫酸氫鈉在水溶液中的電離:NaHSO4═Na++HSO4- C.氯化銨的水解:NH4++H2O?NH4OH+H+ D.氯化銀的沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) 組卷:3引用:3難度:0.7 -
5.某同學在實驗報告中記錄了下列數據,其中正確的是( )
A.用50mL量筒量取22.36mL鹽酸 B.用廣泛pH試紙測出某溶液pH為3.5 C.用托盤天平稱取8.75g食鹽 D.用酸式滴定管測出消耗鹽酸的體積為19.60mL 組卷:6引用:2難度:0.9 -
6.在下列各說法中,正確的是( )
A.△H>0表示放熱反應,△H<0表示吸熱反應 B.熱化學方程式中的化學計量數只表示物質的量,可以是分數 C.1 mol H2SO4與1 mol Ba(OH)2反應生成BaSO4沉淀時放出的熱叫做中和熱 D.1 mol H2與0.5 mol O2反應放出的熱就是H2的燃燒熱 組卷:1040引用:39難度:0.9 -
7.室溫下,若溶液中由水電離產生的c(OH-)=1×10-13mol?L-1,滿足此條件的溶液中一定可以大量共存的離子組是( )
A.Fe3+、Na+、NO3-、Cl- B.K+、Ba2+、Cl-、NO3- C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、HCO3- 組卷:18引用:7難度:0.7 -
8.防止鋼鐵腐蝕的方法很多,下列屬于外加電流法的是( )
A. 
B. 
C. 
D.  組卷:10引用:1難度:0.5
組卷:10引用:1難度:0.5 -
9.下列關于化學反應速率的說法正確的是( )
A.升高溫度可提升分子平均能量,增大化學反應的活化能,使化學反應速率加快 B.有氣體參加的化學反應,若增大壓強(即縮小反應容器的容積),可增加活化分子的百分數,從而使反應速率加快 C.0.1mol?L-1鹽酸和0.1mol?L-1硝酸與相同形狀和大小的大理石反應的速率相同 D.在相同溫度下,兩個相同的容器中,分別充入相同物質的量的Br2和Cl2,與等量的氫氣發生反應的速率相同 組卷:11引用:1難度:0.7 -
10.物質的量濃度相同的下列溶液,pH由大到小排列正確的是( )
A.Ba(OH)2、NaF、FeCl3、KCl B.NH3?H2O、H3PO4、Na2SO4、H2SO4 C.Na2SiO3、K2CO3、KNO3、NH4Cl D.NaHSO3、CH3COOH、C2H5OH、HCl 組卷:11引用:1難度:0.7
二、非選擇題(本題包括5個小題,共50分)
-
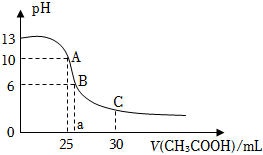 29.25℃時,CH3COOH的電離常數Ka=1.8×10-5。常溫下,往25mL氫氧化鈉標準溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,pH變化曲線如圖所示:
29.25℃時,CH3COOH的電離常數Ka=1.8×10-5。常溫下,往25mL氫氧化鈉標準溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,pH變化曲線如圖所示:
(1)該氫氧化鈉溶液的物質的量濃度為。
(2)A點對應的橫坐標為25mL,請用離子方程式解釋A點所示的溶液顯堿性的原因:。
(3)C點所示溶液為等濃度的 CH3COONa和CH3COOH混合溶液,請判斷該溶液中c(CH3COOH)c(CH3COO-)(填“>”“<”或“=”)。
(4)B點所示溶液中,=c(CH3COO-)c(CH3COOH)。
(5)廢水中的重金屬離子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,國家規定的排放標準:鎳低1.1×10-5mol?L-1,銅低于7.8×10-5mol?L-1,則需要控制溶液中S2-的濃度不低于mol?L-1。組卷:5引用:2難度:0.6 -
 30.硫化氫(H2S)是一種有毒氣體,對環境和人體健康造成極大的危害,工業上采用多種方法減少H2S的排放。
30.硫化氫(H2S)是一種有毒氣體,對環境和人體健康造成極大的危害,工業上采用多種方法減少H2S的排放。
(1)去除廢氣中H2S的相關熱化學方程式如下:
①2H2S(g)+3O2(g)═2H2O(l)+2SO2(g)△H=akJ?mol-1
②2H2S(g)+O2(g)═2H2O(l)+2S(s)△H=bkJ?mol-1
反應①自發進行的條件是(填“高溫”“低溫”或“任意溫度”)。
(2)為了有效去除廢氣中的H2S,在燃燒爐中通入的H2S和空氣(O2的體積分數約為20%)的體積比一般控制在0.4,理由是。
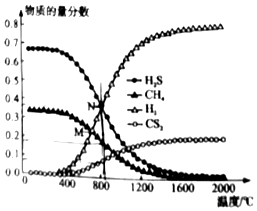
(3)在一密閉體積可變容器中,起始時向該容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,發生反應:CH4(g)+2H2S(g)?CS2(g)+4H2(g),0.11MPa恒壓下,溫度變化對平衡時產物的物質的量分數的影響如圖所示:
為提高H2S的平衡轉化率,除改變溫度外,還可采取的措施是(列舉一條)。
N點對應溫度下,該反應的分壓表示的平衡常數表達式KP=,平衡常數KP=MPa。組卷:20引用:1難度:0.5


