2021-2022學年北京十五中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、第一部分(選擇題共42分)
-
1.下列溶液呈中性的是( )
A.FeCl3溶液 B.Na2CO3溶液 C.NaCl溶液 D.CH3COONa溶液 組卷:40引用:2難度:0.8 -
2.下列物質屬于弱電解質的是( )
A.NH3?H2O B.NaOH C.CaCl2 D.H2SO4 組卷:24引用:1難度:0.6 -
3.下列溶液一定顯酸性的是( )
A.c(H+)>c(OH-) B.含有H+ C.pH<7 D.酚酞變紅 組卷:55引用:6難度:0.8 -
4.工業上處理含CO、SO2煙道氣的一種方法是將其在催化劑作用下轉化為S和CO2。
已知:2CO(g)+O2(g)═2CO2(g)ΔH=-566kJ/mol
S(s)+O2(g)═SO2(g)ΔH=-296kJ/mol
則該條件下2CO(g)+SO2(g)═S(s)+2CO2(g)的ΔH等于( )A.-270kJ/mol B.+26kJ/mol C.-582kJ/mol D.+270kJ/mol 組卷:279引用:16難度:0.8 -
5.CuCl2溶液中存在如下平衡,下列可使黃綠色的CuCl2溶液變成藍色的方法是( )
[Cu(H2O)4]2++4Cl??[CuCl4]2?+4H2O ΔH>0
(藍色) (黃色)A.升溫 B.加NaCl(s) C.加壓 D.加AgNO3溶液 組卷:11引用:1難度:0.5 -
 6.將同濃度、同體積的鹽酸與醋酸分別與足量的鎂條反應,測得密閉容器中壓強隨時間的變化曲線如圖所示。下列說法不正確的是( )
6.將同濃度、同體積的鹽酸與醋酸分別與足量的鎂條反應,測得密閉容器中壓強隨時間的變化曲線如圖所示。下列說法不正確的是( )A.反應開始前c(H+):鹽酸>醋酸 B.反應過程中鹽酸中c(H+)下降更快 C.曲線②表示鹽酸與鎂條反應 D.反應結束時兩容器內n(H2)相等 組卷:40引用:4難度:0.6
二、第二部分(非選擇題共58分)
-
18.研究電解質在水溶液中的離子反應與平衡有重要的意義。
(1)常溫下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LCH3COOH溶液的滴定曲線如圖所示。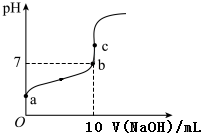
①a點溶液的pH1(填“>”、“<”或“=”),請用化學用語解釋其原因。
②b點溶液中的溶質為(填化學式)。
③c點溶液中,c(Na+)[c(CH3COO?)+c(CH3COOH)]。c點c(CH3COO?)+c(CH3COOH)0.1mol/L(填“>”、“<”或“=”)
④a、b、c三點中,水的電離程度最大的點為。
(2)用電位滴定法模擬測定某醋酸溶液樣品中醋酸的含量,操作如下:
已知:該條件下,醋酸和NaOH以物質的量1:1反應時得到的溶液pH為8.7。
i.準確量取10.00mL醋酸溶液樣品,加入蒸餾水至總體積為100.00mL,取其中20.00mL進行滴定實驗,用酸度計檢測pH變化;
ii.逐滴滴入0.1000mol?L-1的NaOH溶液,酸度計顯示pH=8.7停止滴定,記錄消耗的NaOH溶液的體積V(NaOH);
iii.平行測定多次(數據見表1);
iv.分析處理數據。
表1實驗數據記錄表格
①在滴定過程中,在滴定過程中,若出現下列情況,測定結果偏低的是編號 1 2 3 4 V(NaOH)/mL 23.99 25.00 24.01 24.00 。
A.滴定前用待滴定的醋酸溶液潤洗錐形瓶
B.在振蕩錐形瓶時不慎將瓶內溶液淺出
C.若在滴定過程中不慎將數滴堿液滴錐形瓶外
D.用蒸餾水洗滌堿式滴定管后即使用,沒有用堿液潤洗
②根據表1中的有效數據,計算消耗的NaOH溶液的平均體積V(NaOH)=mL。該醋酸溶液樣品中醋酸的含量是g/L。[M(CH3COOH)=60g?mol-1]
(3)已知:25℃時CH3COOH、H2CO3和HClO的電離平衡常數:
①CH3COOH的電離平衡常數表達式Ka=化學式 CH3COOH H2CO3 HClO 電離平衡常數
(Ka)1.75×10-5 Ka1=4.5×10-7
Ka2=4.7×10-114.0×10-8 。
②25℃時,濃度均為0.1mol/L的CH3COONa溶液、NaHCO3溶液、NaClO溶液的堿性由大到小的排序是
③25℃時,若初始時次氯酸溶液中HClO的物質的量濃度為0.1mol/L,達到電離平衡時溶液中c(H+)=mol/L。
④下列化學反應可能發生的是。
A.HClO+CH3COONa═CH3COOH+NaClO
B.CH3COOH+Na2CO3═NaHCO3+CH3COONa
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑組卷:37引用:2難度:0.6 -
19.實驗小組探究酸對Fe3++3SCN-?Fe(SCN)3 平衡的影響。將0.005mol/L FeCl3溶液(接近無色)和0.01 mol/L KSCN溶液等體積混合,得到紅色溶液。取兩等份紅色溶液,進行如下操作并記錄現象。
(1)FeCl3水解顯酸性的原因是。(用離子方程式表示)
(2)甲同學認為加入酸后,會使Fe3++3SCN-?Fe(SCN)3體系中濃度改變,導致該平衡正向移動,溶液顏色加深。
【設計并實施實驗】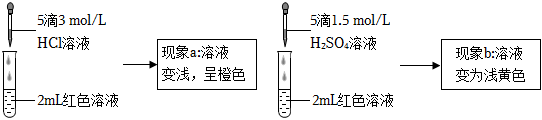
【查閱資料】
Fe3+和Cl-、均能發生絡合反應:SO2-4
Fe3++4Cl-?[FeCl4]-(黃色);Fe3++2?[Fe(SO4)2]-(無色)。SO2-4
實驗Ⅰ.探究現象a中溶液顏色變化的原因如表1:
表1:
(3)實驗①的目的是編號 操作 現象 ① 向2mL紅色溶液中滴加5滴水 溶液顏色無明顯變化 ② 向2mL紅色溶液中滴加5滴3mol/L KCl溶液 溶液顏色變淺,呈橙色 。
(4)根據實驗①和實驗②的結果,從平衡移動角度解釋現象a:。
實驗Ⅱ.探究現象b中溶液呈淺黃色的原因如表2
表2:
(5)結合實驗③可推測現象b中使溶液呈淺黃色的微粒可能有兩種,分別是編號 操作 現象 ③ 取1 mL 0.0025 mol/L Fe2(SO4)3溶液(無色),加入1mL 0.01 mol/L KSCN溶液,再加入5滴1.5 mol/L H2SO4溶液 溶液先變紅,加硫酸后變為淺黃色 ④ 取1 mL 0.005 mol/L FeCl3溶液, 。
(6)乙同學進一步補充了實驗④,確證了現象b中使溶液呈淺黃色的微粒只是(5)中的一種,請將實驗④的操作及現象補充完整:。組卷:121引用:6難度:0.7


