2022-2023學年北京市101中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、本部分共21題,每題2分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列對生產生活中事實的解釋不正確的是( )
選項 事實 解釋 A 合成氨選擇鐵觸媒做催化劑 鐵觸媒能提高反應的活化能 B 用醋酸能除去水垢中的CaCO3 醋酸的酸性強于碳酸 C 用Al2(SO4)3凈化天然水 Al3+和天然水中HCO3-的水解相互促進,生成Al(OH)3膠體,吸附水中懸浮物,加速其沉降 D 用BaSO4作內服造影劑 胃液中的H+對BaSO4的沉淀溶解平衡基本沒有影響,Ba2+可以保持在安全濃度范圍內 A.A B.B C.C D.D 組卷:90引用:7難度:0.6 -
2.下列說法正確的是( )
A.放熱反應一定是自發反應 B.熵增的反應不一定是自發反應 C.固體溶解一定是熵減小的過程 D.非自發反應在任何條件下都不能發生 組卷:312引用:13難度:0.8 -
3.用90%的普通汽油與10%的燃料乙醇調和成乙醇汽油,可節省石油資源。已知乙醇的摩爾燃燒焓為-1366.8kJ?mol-1,下列表示乙醇燃燒反應的熱化學方程式正確的是( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)ΔH=-1366.8kJ?mol-1 B.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)ΔH=-1366.8kJ?mol-1 C.C2H5OH(l)+2O2(g)═2CO(g)+3H2O(l)ΔH=-1366.8kJ?mol-1 D.C2H5OH+3O2═2CO2+3H2O ΔH=-1366.8kJ?mol-1 組卷:157引用:8難度:0.5 -
4.下列“鐵釘鍍銅”實驗裝置設計正確的是( )
A. 
B. 
C. 
D.  組卷:96引用:5難度:0.7
組卷:96引用:5難度:0.7 -
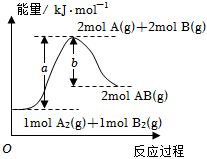 5.反應A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )
5.反應A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )A.1molA2(g)和1molB2(g)的內能之和為akJ B.該反應每生成2個AB分子,吸收能量(a-b)kJ C.該反應每生成1molAB,放出能量bkJ D.反應A2(g)+B2(s)═2AB(g)ΔH=xkJ?mol-1,則x>(a-b) 組卷:187引用:7難度:0.5 -
6.體積恒定的密閉容器中發生反應2NO(g)+2CO(g)?N2(g)+2CO2(g)ΔH<0,其他條件不變時,下列說法正確的是( )
A.升高溫度可使平衡正向移動 B.增大壓強可使化學平衡常數增大 C.移走CO2可提高CO的平衡轉化率 D.使用催化劑可提高NO的平衡轉化率 組卷:123引用:10難度:0.5 -
7.下列實驗中,對現象的解釋不正確的是( )
選項 A B C D 裝
置
及
操
作
向右輕輕推動活塞,壓縮體積

分別測定20℃和80℃蒸餾水的電導率
現
象氣體紅棕色先變深,
再變淺溶液血紅色加深 80℃蒸餾水的電導率大于20℃的 加入CaCO3粉末后電導率增大 解
釋壓強增大,2NO2?N2O4
平衡先逆向移動,再正向移動增大反應物濃度,Fe3++3SCN?Fe(SCN)3平衡正向移動 溫度升高,水的電離
平衡正向移動CaCO3在水中存在CaCO3( s)?Ca2+(aq)+ (aq)CO2-3A.A B.B C.C D.D 組卷:212引用:9難度:0.5 -
8.室溫時,關于1mL1.0×10-2mol?L-1鹽酸的說法不正確的是( )
A.此溶液的pH=2 B.此溶液中,由水電離出的c(H+)=1.0×10-12mol?L-1 C.將此溶液加水稀釋到100mL,所得溶液pH=4 D.將此溶液與9mL1.0×10-3mol?L-1NaOH溶液混合,所得溶液pH=3 組卷:263引用:6難度:0.6
二、解答題(共5小題,滿分58分)
-
25.紅礬鈉(Na2Cr2O7?2H2O)可用于制備制革產業中的鉻鞣劑。對含鉻污泥進行酸浸處理后,得到浸出液(主要含Na+、Ni2+、Cr3+、H+、Cr2O72-和SO42-),經過如圖主要流程,可制得紅礬鈉,實現鉻資源的有效循環利用。

已知:i.Cr(Ⅵ)溶液中存在以下平衡:Cr2O72-+H2O?2CrO42-+2H+
ii.相關金屬離子形成氫氧化物沉淀的pH范圍如下:
(1)Ⅰ中,NaHSO3溶液呈酸性,結合化學用語說明其原因:金屬離子 開始沉淀的pH 沉淀完全的pH Cr3+ 4.3 5.6 Ni2+ 7.1 9.2 。
(2)Ⅱ中,加入NaOH調節pH至(填字母序號)。
a.4.3~5.6
b.4.3~7.1
c.5.6~7.1
D.7.1~9.2
(3)Ⅲ中,H2O2氧化Cr(OH)3沉淀的化學方程式為。
(4)Ⅲ中,在投料比、反應時間均相同時,若溫度過高,Na2CrO4的產率反而降低,可能的原因是。
(5)Ⅳ中,加入H2SO4的作用是(結合平衡移動原理解釋)。
(6)為了測定獲得紅礬鈉(Na2Cr2O7?2H2O)的純度,稱取上述流程中的產品ag配成100 mL溶液,取出25mL放于錐形瓶中,加入稀硫酸和足量的KI溶液,置于暗處充分反應至Cr2O72-全部轉化為Cr3+后,滴入2~3滴淀粉溶液,最后用濃度為c1mol?L-1的Na2S2O3標準溶液滴定,共消耗V1mL。(已知:I2+2S2O32-═2I-+S4O62-)
①滴定終點的現象為。
②所得Na2Cr2O7?2H2O(摩爾質量為298g?mol-1)的純度的表達式為(用質量分數表示)。組卷:241引用:6難度:0.4 -
26.某小組研究FeCl3溶液與Na2SO3溶液之間的反應,過程如下。資料:鐵氰化亞鐵化學式為Fe3[Fe(CN)6]2,是藍色不溶于水的固體。
【進行實驗】
實驗Ⅰ:取配制時加入鹽酸酸化的0.1mol?L-1的FeCl3溶液進行實驗,記錄如下:
(1)配制FeCl3溶液時,通常會加入鹽酸酸化,結合化學用語解釋其原因:實驗步驟 實驗現象 ⅰ.取1mLFeCl3溶液于試管中,加入1mL0.1mol?L-1Na2SO3溶液,再加入1滴K3Fe(CN)6溶液,放置10min 溶液變為黃色,無沉淀生成 ⅱ.從ⅰ所得溶液中取出1mL于試管中,加入??? 生成較多白色沉淀 ⅲ.取1mL0.05mol?L-1Na2SO3溶液于試管中,10min后,加入???(加入試劑種類與順序均與ⅱ相同) 生成少量白色沉淀 。
(2)依據步驟ⅱ、ⅲ的實驗現象,可證明Fe3+與SO32-發生反應生成了SO42-。其中,加入的試劑是、。
(3)步驟ⅲ的目的是。
小組同學對實驗Ⅰ末檢驗到Fe2+的原因進行了進一步探究。
資料:ⅰ.FeCl3溶液中存在平衡:[FeCl6]3-?Fe3++6Cl-
ⅱ.K3Fe(CN)6溶液中存在平衡:[Fe(CN)6]3-?Fe3++6CN-
ⅲ.HCN為一元弱酸。
【繼續實驗】按如下過程進行實驗Ⅱ~Ⅳ,記錄如下:
實驗過程:
(4)實驗Ⅱ中,能證明有Fe2+生成的實驗現象是序號 試劑a 實驗現象 Ⅱ 0.1mol?L-1的FeCl3溶液(未加入鹽酸酸化) 溶液變為褐色,離心分離得到較多藍色沉淀 Ⅲ 向蒸餾水中加入硫酸、FeCl3,調節pH和c(Fe3+)與實驗Ⅰ所用FeCl3溶液相同 溶液為黃色,無沉淀生成 Ⅳ 0.1mol?L-1的FeCl3溶液(未加入鹽酸酸化),加入NaCl調c(Cl-)與____相同 溶液變為褐色,離心分離得到少量藍色沉淀 。
(5)從平衡的角度分析,實驗Ⅲ中,觀察不到有藍色沉淀生成的可能原因是。
(6)補齊實驗Ⅳ的操作:0.1mol?L-1的FeCl3溶液(未加入鹽酸酸化),加入NaCl調c(Cl-)與相同。
(7)由實驗Ⅰ~Ⅳ,可以得到的結論有(至少寫出兩點)。組卷:44引用:3難度:0.6


