2021-2022學年重慶八中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本小題共25小題,每小題3分,共75分)
-
1.《天工開物》被外國學者譽為“17世紀中國工藝百科全書”。下列說法不正確的是( )
A.“凡白土曰堊土,為陶家精美啟用”中“陶”是一種傳統硅酸鹽材料 B.“凡火藥,硫為純陽,硝為純陰”中“硫”指的是硫磺,“硝”指的是硝酸 C.“燒鐵器淬于膽礬水中,即成銅色也”該過程中反應的類型為置換反應 D.“每紅銅六斤,入倭鉛四斤,先后入罐熔化,冷定取出,即成黃銅”中的黃銅是合金 組卷:63引用:5難度:0.8 -
2.下列有關物質組成和分類的說法正確的是( )
A.淀粉、纖維素、聚氯乙烯都是天然高分子化合物 B.滌綸、白紙、手機貼膜的主要成分都是合成纖維 C.活潑非金屬元素的含氧酸和無氧酸可能都是強電解質 D.硫酸銨、磷酸氫鈣、碳酸氫鋰都是酸式鹽 組卷:8引用:1難度:0.7 -
3.下列說法中正確的是( )
A.根據是否具有丁達爾效應,可將分散系分為溶液、濁液和膠體 B.Na2O2、Fe2O3、CaO既屬于堿性氧化物,又屬于離子化合物 C.干冰、鹽酸都是電解質 D.有單質參加的化合反應一定是氧化還原反應,沒有單質參加的化合反應也可能是氧化還原反應 組卷:1引用:1難度:0.7 -
4.下列有關物質的性質與用途具有對應關系的是( )
A.FeCl3具有氧化性,可用作H2S的脫除劑 B.Al2O3具有兩性,可用于工業冶煉鋁單質 C.濃硝酸具有酸性,可用于鈍化鐵、鋁 D.二氧化硅的熔點高,可用于制備光導纖維 組卷:21引用:2難度:0.6 -
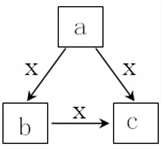 5.X常溫下為氣體,a、b、c是中學化學常見物質,均由常見元素組成,轉化關系(反應條件略去)如圖所示,下列說法不正確的是( )
5.X常溫下為氣體,a、b、c是中學化學常見物質,均由常見元素組成,轉化關系(反應條件略去)如圖所示,下列說法不正確的是( )A.若b為固態非金屬單質,b與X所含元素同主族,則c也能與X反應 B.若X為O2,a為一種固態單質,則c可能為CO2或SO3 C.若a、b、c焰色反應均呈黃色,水溶液均呈堿性,則a中可能既含有離子鍵又含有共價鍵 D.若b為氣態非金屬單質,b與X所含元素同周期,則X與b所含元素原子的核電荷數相差1 組卷:15引用:1難度:0.5 -
6.已知某置換反應可以表示為:

則下列有關說法不正確的是( )A.若A、B都是短周期元素,則B的原子序數可能是A的兩倍 B.若乙是一種常見的半導體材料,則通過該反應說明A的非金屬性一定比B強 C.若A、B均為非金屬元素,則該反應過程中可能會產生白煙 D.該反應可用于某些金屬的冶煉 組卷:31引用:2難度:0.5 -
 7.一種由短周期主族元素組成的化合物(如圖所示),具有良好的儲氫性能,其中元素W、X、Y、Z的原子序數依次增大、且總和為24.下列有關敘述錯誤的是( )
7.一種由短周期主族元素組成的化合物(如圖所示),具有良好的儲氫性能,其中元素W、X、Y、Z的原子序數依次增大、且總和為24.下列有關敘述錯誤的是( )A.該化合物中,W、X、Y之間均為共價鍵 B.Z的單質既能與水反應,也可與甲醇反應 C.Y的最高化合價氧化物的水化物為強酸 D.X的氟化物XF3中原子均為8電子穩定結構 組卷:1643引用:19難度:0.5 -
8.NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.2.24LN2和2.24LCO所含電子數均為1.4NA B.用含1molFeCl3的溶液制得的Fe(OH)3膠體中含膠粒數為NA C.1molNa2O2固體中含離子總數為4NA D.42g乙烯和丙烯混合氣體中氫原子的個數為6NA 組卷:5引用:1難度:0.8 -
9.某溫度下,物質X2SO4的飽和溶液的密度為ρg?mL-1,c(X+)=cmol?L-1,溶質的質量分數為a%,溶質的摩爾質量為Mg?mol-1,溶解度為S g。下列表達式正確的是( )
A.S= 100cM2000ρ-cMB.c= 200ρaMC.a%= c2000ρD.S= a%1-a%組卷:21引用:1難度:0.4 -
10.在T℃時,將a g NH3完全溶于水,得到V mL溶液,假設該溶液的密度為ρ g?cm-3,溶質的質量分數為w,其中含NH4+的物質的量為b mol.下列敘述中正確的是( )
A.溶質的質量分數為w= ×100%aVρ-aB.上述溶液中再加入V mL水后,所得溶液溶質的質量分數大于0.5w C.溶液中c(OH-)= mol?L-11000bVD.溶質的物質的量濃度c= mol?L-11000a17V組卷:43引用:8難度:0.7
二、非選擇題(本小題共5小題,共75分)
-
29.鈦酸鋇(BaTiO3)在工業上有重要用途,主要用于制作電子陶瓷、PTC 熱敏電阻、電容器等多種電子元件。以下是生產鈦酸鋇的一種工藝流程圖:
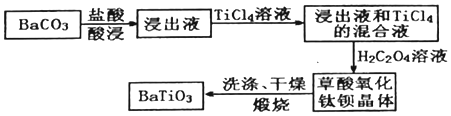
已知:①草酸氧化鈦鋇晶體的化學式為BaTiO(C2O4)?4H2O;
②25℃時,BaCO3的溶度積Ksp=2.58×10-9;
(1)BaTiO3中Ti 元素的化合價為:。
(2)用鹽酸酸溶時發生反應的離子方程式為:。
(3)流程中通過過濾得到草酸氧化鈦鋇晶體后,為提高產品質量需對晶體洗滌。
①過濾操作中使用的玻璃儀器有。
②如何證明晶體已洗凈?。
(4)TiO2具有很好的散射性,是一種有重要用途的金屬氧化物。工業上可用TiCl4水解來制備,制備時需加入大量的水,同時加熱,其目的是:。
(5)某興趣小組取19.70gBaCO3模擬上述工藝流程制備BaTiO3,得產品13.98g,BaTiO3的產率為:。
(6)流程中用鹽酸酸浸,其實質是BaCO3溶解平衡的移動。若浸出液中c(Ba2+)=0.1mol/L,則c(CO32-)在浸出液中的最大濃度為mol/L。組卷:30引用:4難度:0.5 -
30.硫代硫酸鈉(Na2S2O3)在生產生活中具有廣泛應用。回答下列問題:
I.工業上普遍使用Na2SO3與硫磺共煮制備Na2S2O3,裝置如圖1。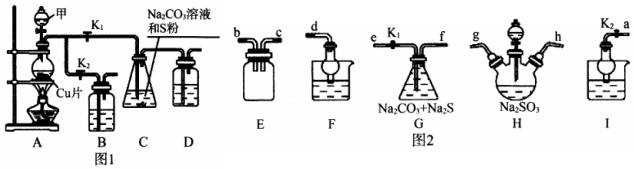
(1)打開K1、關閉K2,向圓底燒瓶中加入足量試劑甲并加熱。試劑甲為,裝置B和D的作用是。
(2)始終保持C中溶液呈堿性、加熱產生Na2S2O3,反應的化學方程式為。反應一段時間后,C中硫粉逐漸減少,及時打開K2、關閉K1并停止加熱,將C中所得混合物分離提純后即得到Na2S2O3.若不及時關閉K1,將導致C中溶液呈酸性、發生副反應產生S和。
Ⅱ.利用SO2與Na2CO3、Na2S的混合溶液反應也能制備Na2S2O3,所需儀器如圖2。
(1)裝置G中Na2CO3與Na2S的最佳物質的量之比為。
(2)從左到右連接各儀器,接口順序為:接g、h接、接、接d。
Ⅲ常用Na2S2O3溶液測定廢水中Ba2+濃度。
取廢水20.00mL,控制適當的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;過濾、洗滌后用適量稀酸溶解,此時CrO42-全部轉化為Cr2O72-;再加過量KI溶液,將Cr2O72-充分反應:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后加入淀粉溶液作指示劑,用0.0100mol/L的Na2S2O3溶液進行滴定:I2+2S2O32-═S4O62-+2I-。
當溶液即為終點。平行滴定3次,消耗Na2S2O3溶液的平均用量為18.00mL,則該廢水中Ba2+的物質的量濃度為。組卷:224引用:3難度:0.5


