2023-2024學年湖南省長沙市長郡中學高二(上)期中化學試卷
發布:2024/10/14 10:0:2
一、單項選擇題(本題共14個小題,每小題3分,共42分)
-
1.下列關于工業合成氨的敘述正確的是( )
A.及時從反應體系中分離出氨氣,有利于平衡向正反應方向移動 B.催化劑能縮短反應達到平衡狀態所用的時間,而壓強無此作用 C.工業合成氨的反應是熵增的放熱反應,在任何溫度下都能自發進行 D.高溫、高壓都能縮短反應達到平衡狀態所用的時間,而只有高溫有利于提高合成氨的產率 組卷:122引用:7難度:0.6 -
2.向盛有5mL0.005mol/LFeCl3溶液的試管中加入5mL0.015mol/LKSCN溶液,觀察現象。將上述溶液平均分裝在a、b、c三支試管中,向試管b中加入少量鐵粉,向試管c中滴加vmLxmol/LKSCN溶液,觀察試管b、c中溶液顏色的變化,并均與試管a對比。下列說法正確的是( )
A.FeCl3溶液和KSCN溶液可以產生紅色沉淀 B.b試管中的現象說明:當其他條件不變時,增大生成物濃度平衡向逆反應方向移動 C.為了證明其他條件不變時,增大反應物的濃度平衡向正反應方向移動,則x應該盡可能的大,而v應該盡可能的小 D.若向試管a中加入4滴1mol/L的KCl溶液,溶液顏色會變深 組卷:12引用:2難度:0.5 -
3.用0.1000mol/LNaOH溶液滴定20.00mL的稀醋酸,測定稀醋酸的濃度。下列說法錯誤的是( )
A.潤洗滴定管的方法:從滴定管上口加入3~5mL所要盛裝的酸或堿,傾斜著轉動滴定管,使液體潤濕全部滴定管內壁,然后將液體從滴定管上口放入預置的燒杯中 B.趕出堿式滴定管乳膠管中氣泡的方法如圖所示 
C.該滴定實驗可選用酚酞作指示劑 D.當加入半滴NaOH溶液后,溶液變色,立即讀數,可能導致測定結果偏小 組卷:44引用:3難度:0.6 -
4.已知:N2(g)+3H2(g)?2NH3(g)ΔH═-92.4kJ/mol。若斷裂1molH-H、1molN-H需要吸收的能量分別為436kJ、391kJ,則斷裂1molN≡N需要吸收的能量為( )
A.431kJ B.945.6kJ C.649kJ D.869kJ 組卷:156引用:25難度:0.5 -
5.已知25℃時,關于0.1mol/L醋酸溶液(Ka=1.75×10-5),下列說法正確的是( )
A.升高溫度,醋酸的電離程度增大,c(H+)增大 B.向該溶液中通入HCl氣體,平衡逆向移動,c(H+)減小 C.該溫度下,該溶液中醋酸的電離程度大于0.01mol/L醋酸溶液中醋酸的電離程度 D.加水稀釋后,溶液中 增大c(CH3COOH)c(CH3COO-)組卷:29引用:4難度:0.6 -
6.鉀的化合物對調節體內循環有重要用途,一定溫度下,下列溶液中的離子濃度關系式正確的是( )
A.K2S溶液中:2c(K+)=c(S2-)+c(HS-)+c(H2S) B.K2CO3溶液中:c(OH-)=c(H+)+c( )+2c(H2CO3)HCO-3C.0.1mol?L-1的KHCO3溶液中:c(K+)+c(H+)=c( )+c(HCO-3)+c(OH-)CO2-3D.pH相同的①CH3COOK、②KOH、③KClO三種溶液中的c(K+):③>①>② 組卷:304引用:6難度:0.5
二、非選擇題(本題共4個小題,共58分)
-
 17.三元催化器是安裝在汽車排氣系統中最重要的機外凈化裝置。高溫汽車尾氣中的一氧化碳、碳氫化合物和氮氧化物在通過凈化裝置時活性增強,發生氧化還原反應變成無害氣體而得以凈化。
17.三元催化器是安裝在汽車排氣系統中最重要的機外凈化裝置。高溫汽車尾氣中的一氧化碳、碳氫化合物和氮氧化物在通過凈化裝置時活性增強,發生氧化還原反應變成無害氣體而得以凈化。
(1)汽車尾氣中的CO是由于汽油在氣缸內不均勻、不充分燃燒導致的,而生成NO的化學方程式為。
(2)在某溫度下,向恒溫恒容密閉容器中充入等物質的量濃度的NO2和CO氣體,在催化劑作用下發生反應4CO(g)+2NO2(g)?N2(g)+4CO2(g)ΔH<0。相關數據如下:
①上述反應0min 5min 10min 15min 20min c(NO2)/(mol?L-1) 2.00 1.70 1.56 1.50 1.50 c(N2)/(mol?L-1) 0 0.15 0.22 0.25 0.25 自發進行(填“高溫”“低溫”或“永不”)。
②在0~10min內,以CO2的濃度變化表示的反應速率為mol/(L?min),在15min時,CO的轉化率為。此溫度下,該反應的化學平衡常數K=(保留兩位有效數字)。
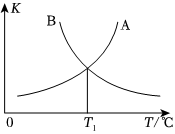
③該反應的正、逆反應的平衡常數(K)與溫度(T)的關系如圖所示,其中表示正反應化學平衡常數的是(選“A”或“B”),理由是。
④在該溫度下,向該容器中通入含CO、NO2、N2和CO2的混合物,容器中各組分濃度均為2mol/L,則此時上述反應向進行(填“正反應方向”“逆反應方向”或“不能確定”)。組卷:8引用:1難度:0.5 -
18.根據要求回答下列問題。
(1)常溫下,pH=10的CH3COONa溶液中水電離出來的c(OH-)=mol?L-1。
(2)pH相同的①NaCN,②NaClO,③Na2S三種溶液,其物質的量濃度由大到小的順序為(填序號)。已知:弱酸的電離平衡常數HCN:Ka=4×10-10;H2S:Ka1=1×10-7,Ka2=7×10-15;HClO;Ka=3×10-8。
(3)能夠利用氯化銨溶液的酸性作金屬除銹劑,試用離子方程式表示氯化銨溶液呈酸性的原因:。
(4)將0.1mol?L-1Na2CO3溶液與0.1mol?L-1鹽酸等體積混合,所得溶液中c()CO2-3c(H2CO3)(填“<”“=”或“>”)。
(5)常溫下,將某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等體積混合,兩種溶液的物質的量濃度和混合溶液的pH如下表所示:
①從甲組實驗結果分析,該混合溶液中離子濃度由大到小的順序是實驗編號 c(HA)/(mol?L-1) c(NaOH)/(mol?L-1) 混合溶液的pH 甲 0.2 0.1 >7 乙 0.1 0.1 =10 。
②分析乙組實驗數據,寫出該混合溶液中下列算式的精確結果(列式即可):c(Na+)-c(A-)=mol?L-1。
(6)分析化學中,以AgNO3標準溶液滴定溶液中的Cl-時,采用K2CrO4作指示劑,利用Ag+與反應生成磚紅色沉淀指示滴定終點。當溶液中的Cl-恰好沉淀完全(濃度等于1×10-5mol?L-1)時,溶液中c(CrO2-4)=CrO2-4mol?L-1。(結果保留兩位有效數字,已知常溫時Ag2CrO4、AgCl的Ksp分別為2.0×10-12和1.8×10-10)組卷:38引用:3難度:0.5


