2021-2022學(xué)年廣東省汕頭市澄海中學(xué)高二(上)期中化學(xué)試卷
發(fā)布:2024/12/14 7:30:2
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項(xiàng)符合題目要求。
-
1.我國提出爭取在2030年前實(shí)現(xiàn)碳達(dá)峰,2060年實(shí)現(xiàn)碳中和,這對于改善環(huán)境,實(shí)現(xiàn)綠色發(fā)展至關(guān)重要。碳中和是指CO2的排放總量和減少總量相當(dāng)。下列措施中能促進(jìn)碳中和最直接有效的是( )
A.推行生活垃圾分類 B.大規(guī)模開采可燃冰作為新能源 C.通過清潔煤技術(shù)減少煤燃燒污染 D.研發(fā)催化劑將CO2還原為甲醇 組卷:15引用:1難度:0.6 -
2.化學(xué)在生活中的應(yīng)用隨處可見,下列措施不是為了改變化學(xué)反應(yīng)速率的是( )
A.將食物存放在冰箱中 B.加工饅頭時添加膨松劑 C.糕點(diǎn)包裝袋內(nèi)放置除氧劑 D.冶鐵時將鐵礦石粉碎 組卷:30引用:5難度:0.7 -
3.合成氨工業(yè)中,原料氣中的雜質(zhì)CO在進(jìn)入合成塔之前需經(jīng)過銅氨液處理,其反應(yīng)為Cu(NH3)2+(aq)+CO(g)+NH3(g)?[Cu(NH3)3CO]+(aq)+Q(Q>0);吸收CO后的溶液經(jīng)過適當(dāng)處理又可再生,再生的適宜條件是( )
A.高溫低壓 B.高溫高壓 C.低溫低壓 D.低溫高壓 組卷:52引用:2難度:0.6 -
4.測定濃硫酸試劑中H2SO4含量的主要操作包括:①量取一定量的濃硫酸,稀釋;②轉(zhuǎn)移定容得待測液;③移取20.00mL待測液,用0.1000mol/L的NaOH溶液滴定。上述操作中,不需要用到的儀器為( )
A. 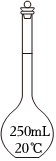
B. 
C. 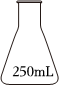
D.  組卷:459引用:15難度:0.5
組卷:459引用:15難度:0.5 -
5.海水中因含有HCO3-和CO32-等離子,其pH穩(wěn)定在7.9~8.4。下列說法錯誤的是( )
A.海水的弱堿性有利于珊瑚蟲利用碳酸鈣形成外殼 B.人口增長、燃燒煤、大規(guī)模砍伐森林等因素,會造成海水的酸化 C.夏天,海水的pH會減小 D.弱堿性的海水,可用作煙道氣中SO2的吸收劑 組卷:4引用:1難度:0.7 -
6.下列說法正確的是( )
A.在c(H+)=1.0×10-13mol?L-1的溶液中,NH4+、Br-、NO3-、SO32-不能大量共存 B.pH試紙?jiān)谑褂们靶枰葷櫇?/label> C.強(qiáng)電解質(zhì)溶液的導(dǎo)電能力一定比弱電解質(zhì)溶液的強(qiáng) D.在合成氨生產(chǎn)過程中,壓強(qiáng)越大越好 組卷:3引用:1難度:0.6 -
7.“接觸法制硫酸”的主要反應(yīng)2SO2+O2
2SO3在催化劑表面的反應(yīng)歷程如圖:催化劑△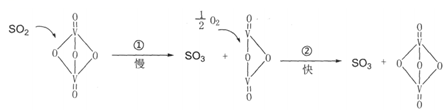
下列說法錯誤的是( )A.使用上述催化劑不能改變該反應(yīng)的焓變 B.反應(yīng)②的活化能比反應(yīng)①大 C.過程中既有V-O鍵的斷裂,也有V-O鍵的形成 D.該反應(yīng)的催化劑是V2O5 組卷:33引用:1難度:0.4
三、非選擇題:本題共5小題,滿分56分。
-
 20.利用化學(xué)反應(yīng)原理研究化學(xué)反應(yīng)有重要意義。亞硝酰氯(NOCl)是有機(jī)合成中的重要試劑,工業(yè)上可由NO與Cl2反應(yīng)制得,回答下列問題:
20.利用化學(xué)反應(yīng)原理研究化學(xué)反應(yīng)有重要意義。亞硝酰氯(NOCl)是有機(jī)合成中的重要試劑,工業(yè)上可由NO與Cl2反應(yīng)制得,回答下列問題:
Ⅰ.(1)氮氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酰氯,涉及如下反應(yīng):2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)ΔH1;
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;
2NO(g)+Cl2(g)?2NOCl(g)ΔH3;
則ΔH3=(用ΔH1和ΔH2表示)。
Ⅱ.工業(yè)上通常用如下反應(yīng)制備亞硝酰氯:2NO(g)+Cl2(g)?2NOCl(g)ΔH<0。
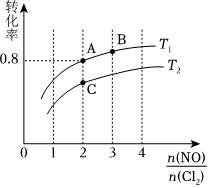
(2)保持恒溫恒容條件,將物質(zhì)的量之和為3mol的NO和Cl2以不同的氮氯比進(jìn)行反應(yīng),平衡時某反應(yīng)物的轉(zhuǎn)化率與氮氯比及不同溫度的關(guān)系如圖所示:n(NO)n(Cl2)
①圖中T1、T2的關(guān)系為T1T2(填“>”“<”或“=”);
②圖中縱坐標(biāo)為物質(zhì)(填化學(xué)式)的轉(zhuǎn)化率。
③該反應(yīng)2NO(g)+Cl2(g)?2NOCl(g)達(dá)到化學(xué)平衡的標(biāo)志有(填字母)。
A.單位時間內(nèi)消耗nmolCl2的同時,生成2nmolNOCl
B.v(NO)=2v(Cl2)
C.容器內(nèi)總壓強(qiáng)不再變化
D.混合氣體的密度保持不變
E.混合氣體的平均相對分子質(zhì)量保持不變
④若容器容積為1 L,B點(diǎn)的平衡常數(shù)為。
⑤若在溫度為T1,容積為1 L的容器中,充入0.5molNO、1molCl2、2molNOCl,v(正)v(逆)(填“<”“>”或“=”)。
(3)已知上述反應(yīng)中逆反應(yīng)速率的表達(dá)式為v逆=k?cn(NOCl)。300℃時,測得逆反應(yīng)速率與NOCl的濃度的關(guān)系如表所示:
根據(jù)以上數(shù)據(jù),可計(jì)算出:①表達(dá)式v逆=k?cn(NOCl)中的n=c(NOCl)/(mol/L) v逆/(mol?L-1?s-1) 0.20 1.6×10-9 0.40 6.4×10-9 ,
②當(dāng)c(NOCl)=0.50mol?L-1時,v逆=mol?L-1?s-1。組卷:8引用:1難度:0.6 -
21.工業(yè)上采用高濃度含砷廢水制取As2O3,工藝流程如圖:
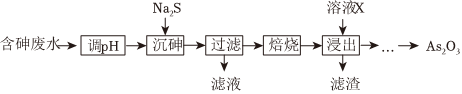
已知含砷廢水中砷元素以+3價的形式存在。不同pH時,三價砷的物種分布如圖所示: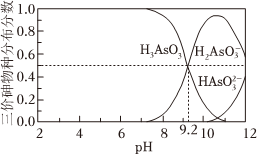
(1)H3AsO3第一步電離方程式H3AsO3?H2+H+的電離常數(shù)為Ka1,則pKa1=AsO-3(已知pKa1=-lgKa1)
(2)“調(diào)pH”時,控制溶液的pH=6,“沉砷”時會生成As2S3沉淀。寫出“沉砷”時反應(yīng)的離子方程式:
(3)“沉砷”時會發(fā)生副反應(yīng):As2S3(s)+3S2-(aq)?2(aq),從而降低砷元素的沉淀率。為減少副反應(yīng)的發(fā)生,采取的方法是加入Na2S的同時加入少量FeSO4,生成的As2S3沉淀中會混有FeS。加入少量FeSO4能抑制副反應(yīng)的原因是(用平衡移動原理解釋)AsS2-3。
(4)“焙燒”含少量FeS的As2S3可以得到As2O3和Fe2O3的混合物。As2O3是一種酸性氧化物,選擇合適的溶液X,將砷元素轉(zhuǎn)化為從混合物中浸出。寫出“浸出”反應(yīng)的離子方程式:AsO3-3。
(5)保持溶液X的濃度不變,為了提高焙燒后固體中砷元素的浸出速率,可以采取的方法有(填兩條):①、②。組卷:6引用:2難度:0.6


