2021-2022學年山東省菏澤市高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.化學與生產、生活密切相關。下列敘述錯誤的是( )
A.為增加肥效,農業生產中同時使用銨態氮肥和草木灰 B.將CO中毒的病人移至高壓氧艙,救治原理與平衡移動有關 C.電熱水器用鎂棒防止內膽腐蝕,原理是犧牲陽極的陰極保護 D.聚合硫酸鐵[Fe2(OH)x(SO4)y]n是新型絮凝劑,可用來處理水中的懸浮物 組卷:3引用:1難度:0.7 -
2.下列事實不能用原電池原理解釋的是( )
A.白鐵(鍍鋅)制品比一般鐵器耐腐蝕 B.鐵片、鋁片在冷的濃硫酸中鈍化 C.工程施工隊在鐵制水管外刷一層“銀粉” D.純鋅與稀硫酸反應時,滴入少量CuSO4溶液后反應速率加快 組卷:35引用:1難度:0.5 -
3.對于任何一個化學平衡體系,以下變化或采取的措施,平衡一定發生移動的是( )
①加入一種反應物,②增大體系的壓強,③升高溫度,④使用催化劑,⑤化學平衡常數減小.A.①②③⑤ B.①②③④⑤ C.③⑤ D.①②③ 組卷:165引用:8難度:0.7 -
 4.體積相同,pH相等的兩種酸HA 與HB溶液分別加水稀釋,pH溶液pH隨加水體積的關系如圖所示。下列說法正確的是( )
4.體積相同,pH相等的兩種酸HA 與HB溶液分別加水稀釋,pH溶液pH隨加水體積的關系如圖所示。下列說法正確的是( )A.HA為強酸,HB為弱酸 B.a點時兩種溶液的濃度c(HA)<c(HB) C.加水稀釋到pH相同時,加水量V(HA)>V(HB) D.兩溶液稀釋100倍,分別與足量NaOH溶液反應消耗的NaOH溶液體積V(HA)>V(HB) 組卷:20引用:1難度:0.6 -
5.用下列實驗裝置(部分夾持裝置略去)進行相關實驗能達到實驗目的的是( )
A. 
利用裝置制備Fe(OH)3膠體B. 
利用裝置蒸干AlCl3溶液制備無水AlCl3固體C. 
利用裝置檢驗該條件下鐵發生了析氫腐蝕D. 
利用裝置測量氣體體積,室溫下將漏斗緩緩下移至兩端的液面處于相平,讀出H2的體積組卷:4引用:1難度:0.5 -
 6.實驗測得0.5mol?L-1CH3COONa 溶液和H2O的 pH隨溫度變化的曲線如圖所示。下面說法正確的是( )
6.實驗測得0.5mol?L-1CH3COONa 溶液和H2O的 pH隨溫度變化的曲線如圖所示。下面說法正確的是( )A.隨溫度升高,H2O的K變小 B.隨溫度升高,H2O中 c(H+)>c(OH-) C.隨溫度升高,CH3COONa溶液的c(OH-)減小 D.隨溫度升高,CH3COONa溶液的pH變化是Kw改變和水解平衡移動共同作用的結果 組卷:39引用:1難度:0.9
三、非選擇題:本題共5小題,共60分。
-
19.氯化亞銅是一種白色粉末,難溶于水,溶于濃鹽酸生成氯亞銅酸,常用作催化劑、殺菌劑。以輝銅礦(主要成分為Cu2S,含少量Fe2O3、SiO2 等雜質)和軟錳礦(主要成分MnO2)為原料制備堿式碳酸銅,并進一步制取氯化亞銅 (CuCl)的工藝流程如圖:
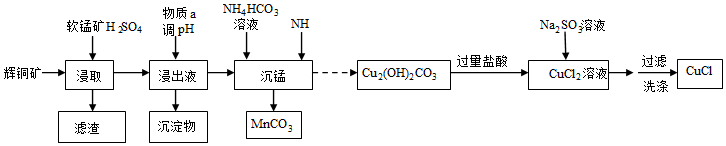
已知:①CS2的沸點為46.2℃
②常溫下幾種物質開始沉淀與完全沉淀時的pH如表
請回答下列問題:金屬離子 Fe2+ Fe3+ Cu2+ Mn2+ 開始沉淀 7.5 2.7 5.6 8.3 完全沉淀 9.0 3.7 6.7 9.8
(1)為加快“浸取”速率,除將輝銅礦粉碎外,還可采取的措施有(任寫一種),浸取過程中得到一種單質,寫出主要反應的化學方程式,該單質可用CS2提取回收,回收過程中溫度應控制在40℃~45℃之間,不宜過高的原因是。
(2)調節pH的范圍為,物質a可選用(填序號)。
A.CuO
B.Fe2O3
C.CuCO3
D.MnO2
(3)“沉錳”時發生反應的離子方程式。
(4)得到的CuCl晶體需用水洗,判斷晶體是否洗滌干凈的操作是。組卷:22引用:2難度:0.6 -
20.研究氮及其化合物的性質及轉化,對研究自然界中氮的循環有著重大的意義。
(1)煤燃燒排放的煙氣含有NOx,在有氧條件下,NO能發生脫硝反應。
①已知:
N2(g)+O2(g)═2NO(g)ΔH=+180.6kJ?mol-1
N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1
H2O(g)═H2(g)+O2(g)ΔH=+241.8kJ?mol-112
則脫硝反應4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)ΔH=kJ?mol-1
②T℃時,向恒容的密閉容器中通入1.20molNO(g)和0.90molNH3(g),發生反應6NO(g)+4NH3(g)?5N2(g)+6H2O(g) ΔH=-1807.0kJ?mol-1,平衡時NO(g)和NH3(g)的物質的量分別為0.60mol和0.50mol,若反應開始的壓強為P0,則該反應的化學平衡常數Kp=( 可用分數表示:用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(2)用Pl-g-C3N4光催化氧化法脫除NO的過程如圖1所示。在酸性水溶液中,光催化脫除原理和電化學反應原理類似。g-C3N4端的反應為O2+2H++2e-═H2O2,則Pl端的反應為。
(3)在一定條件下,將2molNO和1mol O2通入恒容密閉容器中發生反應:2NO(g)+O2(g)?2NO2(g)ΔH<0,2NO2(g)?N2O4(g)ΔH<0,在不同溫度下,測得平衡時體系中NO、O2、NO2的物質的量與溫度的關系如圖2所示。
①曲線c代表的物質的量與溫度的關系,x點對應的O2的轉化率為。
②下列說法正確的是。
A.2NO+O2?2NO2的平衡常數:x點>y點
B.y點時2NO+O2?2NO2的反應速率:v正<v逆
C.x點對應的NO的物質的量分數為411
D.400~1200℃時,隨溫度升高,N2O4體積分數不斷增大組卷:10引用:1難度:0.7


