2013-2014學年四川省綿陽市安縣中學高二(下)入學化學試卷
發布:2024/10/28 4:30:2
一、選擇題(本題共20小題,每小題只有一個選項符合要求,1-10題,每小題2分;11-20題,每小題2分,共50分)
-
1.下列微粒的核外電子的表示方法中正確的是( )
A.基態碳原子的電子排布圖 
B.基態銅原子核外的3d、4s軌道內電子排布圖 
C.Cl的外圍電子排布式3s13p6 D.Fe2+的電子排布式1s22s22p63s23p63d6 組卷:20引用:1難度:0.9 -
2.下列敘述中正確的是( )
A.同一周期中,堿金屬元素的第一電離能最大 B.ⅥA族元素的原子,其半徑越大,越容易得到電子 C.若X原子2p軌道上有一個空軌道,Y原子3p軌道上只有一個空軌道,則它們一定同主族 D.原子核外M層上僅有兩個電子的X原子與原子核外N層上僅有兩個電子的Y原子則它們一定同主族 組卷:15引用:1難度:0.9 -
3.能表示阿伏加德羅常數數值的是( )
A.23g鈉在氧氣中完全燃燒失電子數為0.5NA B.標準狀況下,22.4L苯所含的分子數 C.室溫下,8g甲烷含有共價鍵數為2NA D.1L 1mol?L-1硫酸溶液所含的H+為NA 組卷:2引用:2難度:0.9 -
4.下列敘述中正確的是( )
A.一切四面體空間構型的分子內鍵角均為109°28′ B.Cu(OH)2能溶于過量氨水形成絡合物[Cu(NH3)4]2+,中心離子為Cu2+,配位體是NH3 C.任何晶體,若含陽離子也一定含陰離子 D.水分子穩定是因為水分子間存在氫鍵作用 組卷:32引用:4難度:0.9 -
5.下列敘述中,不能用平衡移動原理解釋的是( )
A.紅棕色的NO2,加壓后顏色先變深后變淺 B.高壓比常壓有利于合成SO3的反應 C.由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深 D.黃綠色的氯水光照后顏色變淺 組卷:235引用:58難度:0.7 -
6.在密閉容器中于一定條件下進行下列反應:2SO2+O2?2SO3當到達平衡時通入18O2,再次平衡時,18O存在于( )
A.SO2、O2 B.SO2、SO3 C.O2、SO3 D.SO2、O2、SO3 組卷:71引用:16難度:0.7 -
7.下列敘述的有關性質,可能屬于金屬晶體的是( )
A 由分子間作用力結合而成,熔點低 B 固體或熔融狀態易導電,熔點在1000℃左右 C 由共價鍵結合成網狀結構,熔點高 D 固體不導電,但溶于水或熔融后能導電 A.A B.B C.C D.D 組卷:97引用:5難度:0.9 -
8.已知下列化學鍵的鍵能(kJ/mol):C-C 346;C=C 610;H-H 436;C-H 413.則反應:CH2=CH2+H2→CH3CH3 的反應熱為( )
A.126kJ B.+126kJ/mol C.-126kJ/mol D.126kJ/mol 組卷:15引用:4難度:0.5
二、填空題(共5小題,每小題10分,滿分50分)
-
24.教材采用圖1實驗裝置測定鋅與稀硫酸反應的速率。
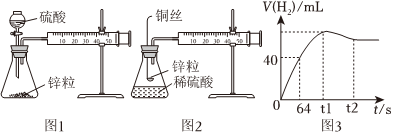
(1)檢查圖1裝置氣密性的操作方法是。
(2)分別取2g顆粒大小相同的鋅粒分別與體積均為40mL的1mol/L硫酸、4mol/L硫酸反應,收集25mL H2時所需時間后者比前者。
(3)同學們在實驗操作中發現,本實驗設計存在明顯不足,例如(舉兩例)。
(4)某化學興趣小組對教材實驗裝置進行圖2所示改進。檢查裝置氣密性后進行的實驗操作有:
a.在多孔塑料袋中裝入鋅粒;
b.在錐形瓶中加入40mL 1mol/L硫酸;
c.塞好橡膠塞,時立即用秒表計時;
d.注射器內每增加5mL氣體時讀取一次秒表。
(5)實驗觀察到鋅與稀硫酸反應初期速率逐漸加快,其原因是,反應進行一定時間后速率逐漸減慢,原因是。
(6)測得產生H2的體積與反應時間的關系曲線如圖3所示,t1~t2時間段氫氣體積略有減小的原因是;在64s內用H+濃度表示的平均反應速率v(H+)=(此時,溶液體積仍為40mL,氣體摩爾體積為25L/mol)。組卷:231引用:2難度:0.1 -
25.CO2的固定和利用在降低溫室氣體排放中具有重要作用,從CO2加氫合成甲醇不僅可以有效緩解減排壓力,還是其綜合利用的一條新途徑.CO2和H2在催化劑作用下能發生反應CO2+3H2?CH3OH+H2O,測得甲醇的理論產率與反應溫度、壓強的關系如圖所示.請回答下列問題:
(1)提高甲醇產率的措施是.
(2)分析圖中數據可知,在220℃、5MPa時,CO2的轉化率為,再將溫度降低至140℃,壓強減小至2MPa,化學反應速率將(填“增大、減小 或 不變 下同),CO2的轉化率將.
(3)200℃時,將0.100molCO2和0.275molH2充入1L密閉容器中,在催化劑作用下反應達到平衡.若CO2的轉化率為25%,則此溫度下該反應的平衡常數K=.
(要求寫出算式和計算結果)
(4)已知:CO的燃燒熱ΔH=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ/mol
CO(g)+2H2(g)=CH3OH(g)ΔH=-90.1kJ/mol
(5)寫出CO2與H2合成甲醇的熱化學方程式.組卷:25引用:2難度:0.5


