2022年湖南省張家界一中高考化學二模試卷
發布:2024/12/30 17:0:3
一、單項選擇題:本題共10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項符合題目要求。
-
1.從科技前沿到日常生活,化學無處不在。下列說法錯誤的是( )
A.在三星堆“祭祀坑”提取到絲綢制品殘留物,其中絲綢主要成分為蛋白質 B.2022年北京冬奧會吉祥物“冰墩墩”使用的聚乙烯屬于高分子材料 C.“天和”核心艙中使用的氮化硼陶瓷基復合材料屬于高分子材料 D.“空氣捕捉”法能實現從空氣中捕獲二氧化碳,利于碳達峰、碳中和 組卷:146引用:7難度:0.8 -
2.LDFCB是電池的一種電解質,該電解質陰離子由同周期元素原子W、X、Y、Z構成,結構如圖,Y的最外層電子數等于X的核外電子總數,下列說法正確的是( )

A.同周期元素第一電離能小于Y的有5種 B.簡單氫化物的還原性:X<Y C.W、Z形成的化合物分子是含有極性鍵的非極性分子 D.四種元素形成的簡單氫化物中X的最穩定 組卷:52引用:2難度:0.5 -
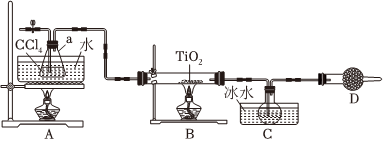 3.我國自主發明的“鈦戰甲”一鈦合金材料,為實現萬米深潛的“奮斗者”號建造了世界最大、搭載人數最多的潛水器載人艙球殼。四氯化鈦(TiCl4)是鈦合金的重要原料,某化學實驗小組以TiO2和足量CCl4為原料制取TiCl4,裝置如圖:
3.我國自主發明的“鈦戰甲”一鈦合金材料,為實現萬米深潛的“奮斗者”號建造了世界最大、搭載人數最多的潛水器載人艙球殼。四氯化鈦(TiCl4)是鈦合金的重要原料,某化學實驗小組以TiO2和足量CCl4為原料制取TiCl4,裝置如圖:
有關物質的性質如表:
下列說法錯誤的是( )物質 熔點/℃ 沸點/℃ 其他性質 CCl4 -23 76.8 與TiCl4互溶 TiCl4 -23 136 遇潮濕空氣產生白霧 A.實驗開始時先點燃A處的酒精燈,再點燃B處 B.B中TiO2發生反應的化學方程式TiO2+CCl4 TiCl4+CO2,該反應是氧化還原反應△C.欲分離C裝置中的TiCl4,應采用的實驗操作為蒸餾 D.鈦合金強度大,能承受劇烈的壓強差考驗,可以適應萬米深潛器的壓強變化 組卷:47引用:4難度:0.5 -
4.40℃時,向100mL水中加入5gMg(OH)2固體溶解,一段時間后再滴入少量稀H2SO4,整個過程pH隨時間的變化如圖所示,下列說法正確的是( )

A.a→b段,由水電離出的c(OH-)逐漸增大 B.b點時,溶液中的c(OH-)=1.0×10-4.09 C.c→e段的變化符合勒夏特列原理 D.e點處,離子濃度大小順序為c(SO42-)>c(Mg2+)>c(OH-)>c(H+) 組卷:31引用:2難度:0.6 -
5.雙極性膜1、2在直流電場作用下能夠將水分離成H+與OH-,可以作為H+與OH-的供應源,用如圖所示的三室式電滲析轉化器可以將有機酸鈉鹽(NaR)轉化制得純度較高的有機弱酸(HR)。下列相關說法正確的是( )
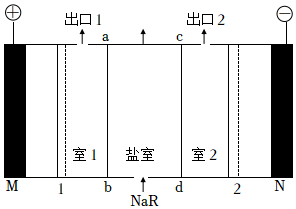
A.ab膜、cd膜分別是陽離子交換膜、陰離子交換膜 B.室1溶液中發生的離子反應為H++R═HR C.M電極的電極反應式為2H++2e-═H2↑ D.鹽室進口處和出口處c(Na+)相等 組卷:63引用:3難度:0.6 -
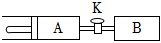 6.如圖所示,向A、B中均充入1molX、1molY,起始時A、B的體積都等于aL。在相同溫度、外界壓強和催化劑存在的條件下,關閉活塞K,使兩容器中都發生反應:X(g)+Y(g)?3Z(g)。達到平衡時,A的體積為1.2aL。下列說法正確的是( )
6.如圖所示,向A、B中均充入1molX、1molY,起始時A、B的體積都等于aL。在相同溫度、外界壓強和催化劑存在的條件下,關閉活塞K,使兩容器中都發生反應:X(g)+Y(g)?3Z(g)。達到平衡時,A的體積為1.2aL。下列說法正確的是( )A.反應速率:v(B)<v(A) B.A容器中X的轉化率為80% C.該反應是一個熵減的反應 D.平衡時Y的體積分數:A<B 組卷:18引用:1難度:0.6
三、非選擇題:本題共5小題,共54分
-
18.一種以精黃銅礦石(主要成分為CuFeS2)為原料生產膽礬晶體的流程如圖:
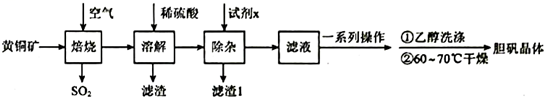
已知:①膽礬高溫下會分解生成CuO;
②焙燒后,Fe元素主要以氧化物形式存在。
焙燒溫度與生成物的主要成分關系如圖所示: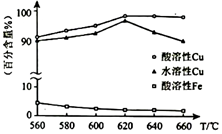
回答下列問題:
(1)根據題目信息,焙燒后的銅主要存在形式為(填化學式),焙燒時發生的主要化學反應方程式為。因焙燒過程中反應放熱,反應器中溫度會不斷升高控制焙燒溫度的方法有(寫出一種即可)。
(2)焙燒時,溫度高于620℃,水溶性Cu(%)下降的原因是。
(3)溶解后濾液中的Cu2+濃度為0.01mol?L-1,則調pH應控制的pH范圍是。已知:當離子濃度減小至10-5mol?L-1時可認為沉淀完全。lg2=0.3;室溫下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.0×10-20。
(4)除雜可以選用的試劑是。
A.CuO
B.Na2CO3
C.Fe2O3
D.Cu2(OH)2CO3
(5)一系列操作包括(填操作名稱),用乙醇洗滌晶體而不用水洗滌的優點是。組卷:34引用:2難度:0.5 -
19.三頸圓底燒瓶是一種常用的化學玻璃儀器,在有機化學實驗中被廣泛使用。可以用該儀器來制備苯乙酸銅以下為實驗室合成路線。
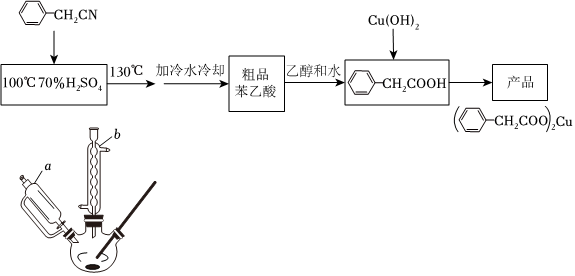
反應的原理為: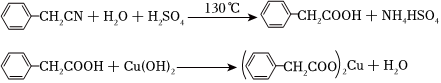
有關數據如下表:
(1)在250mL三頸燒瓶中加入70mL 70%硫酸。配制此硫酸時,加入蒸餾水與濃硫酸的先后順序是藥品 相對分子質量 熔點/℃ 沸點/℃ 溶解性 密度(g?cm-3) 苯乙腈 117 -48 197 微溶于冷水,易溶于乙醇 1.08 苯乙酸 136 76.5 161 微溶于冷水,易溶于乙醇 1.17 。
(2)儀器b的名稱,其作用是;合成苯乙酸時,最合適的加熱方法是。
(3)反應結束后加適量冷水,再分離出苯乙酸粗品。加入冷水的目的是。下列儀器中可用于分離苯乙酸粗品的是。(填標號)
A.分液漏斗
B.漏斗
C.燒杯
D.直形冷凝管
E.玻璃棒
(4)由于苯乙酸的沸點較高,在蒸餾純化操作中最適宜選用的儀器之一是。(填字母)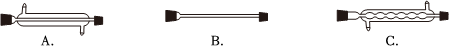
(5)在實驗中原料用量:5.0mL苯乙腈,最終稱得產品質量為3.2g,則所得的苯乙酸的產率為%。(結果保留三位有效數字)
(6)用CuCl2?2H2O和NaOH溶液制備適量Cu(OH)2沉淀,并多次用蒸餾水洗滌沉淀,判斷沉淀洗干凈的實驗操作和現象是。
(7)將苯乙酸加入到乙醇與水的混合溶劑中,充分溶解后,加入Cu(OH)2攪拌30min,過濾,濾液靜置一段時間,析出苯乙酸銅晶體,混合溶劑中乙醇的作用是。組卷:111引用:4難度:0.6


