2022-2023學(xué)年江蘇省南京市六校聯(lián)合體高三(上)調(diào)研化學(xué)試卷(8月份)
發(fā)布:2024/4/20 14:35:0
一.選擇題:共13題,每題3分,共計39分。每題只有一個選項(xiàng)最符合題意。
-
1.中國人民在悠久的歷史中創(chuàng)造了絢麗多彩的中華文化,下列說法不正確的是( )
A.宋?王希孟《千里江山圖》卷中的綠色顏料銅綠的主要成分是堿式碳酸銅 B.“冰糖葫蘆”是一種傳統(tǒng)美食,山楂外面包裹的“糖衣”的主要成分是麥芽糖 C.“澄泥硯”是一種傳統(tǒng)工藝品,是用膠泥燒制而成,其主要成分為硅酸鹽 D.“蜀繡”是用蠶絲線在絲綢或其他織物上繡出圖案的工藝,蠶絲的主要成分蛋白質(zhì) 組卷:6引用:2難度:0.7 -
2.雙氧水和“84”消毒液兩者混合時可發(fā)生反應(yīng):NaClO+H2O2=NaCl+H2O+O2↑。下列有關(guān)說法不正確的是( )
A.Na2O2中含有非極性共價鍵 B.NaClO 的電子式為 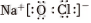
C.H2O2中O元素的化合價為-1 D.H2O的空間構(gòu)型為直線形 組卷:13引用:2難度:0.7 -
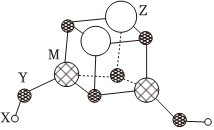 3.短周期元素X、Y、Z、M的原子序數(shù)依次增大,他們組成一種團(tuán)簇分子,結(jié)構(gòu)如圖所示。X、M的族序數(shù)等于周期數(shù),Y是地殼中最豐富、分布最廣的元素,Z原子最外層電子數(shù)為2。下列說法不正確的是( )
3.短周期元素X、Y、Z、M的原子序數(shù)依次增大,他們組成一種團(tuán)簇分子,結(jié)構(gòu)如圖所示。X、M的族序數(shù)等于周期數(shù),Y是地殼中最豐富、分布最廣的元素,Z原子最外層電子數(shù)為2。下列說法不正確的是( )A.該團(tuán)簇分子的分子式為 X2Z2M2Y6 B.簡單離子半徑:Y>M C.工業(yè)上常電解熔融的ZY制取Z單質(zhì) D.第一電離能:M<Z 組卷:27引用:3難度:0.5 -
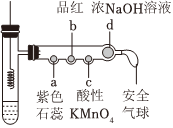 4.若將銅絲插入熱濃硫酸中進(jìn)行如圖(a~d均為浸有相應(yīng)試液的棉花)所示的探究實(shí)驗(yàn),下列分析正確的是( )
4.若將銅絲插入熱濃硫酸中進(jìn)行如圖(a~d均為浸有相應(yīng)試液的棉花)所示的探究實(shí)驗(yàn),下列分析正確的是( )A.Cu與濃硫酸反應(yīng),只體現(xiàn)H2SO4的酸性 B.a(chǎn)處變紅,說明SO2是酸性氧化物 C.b或c處褪色,均說明SO2具有漂白性 D.試管底部出現(xiàn)白色固體,說明反應(yīng)中無H2O生成 組卷:852引用:3難度:0.5 -
5.閱讀下列材料,完成5~7題:
周期表中ⅦA族中氯元素及其化合物在生產(chǎn)、生活中有著廣泛的應(yīng)用。鹽酸工業(yè)用途廣泛,稀鹽酸和稀氫氧化鈉溶液反應(yīng)的中和熱為57.3kJ/mol;氯化鎂,通常含有六個分子的結(jié)晶水,即MgCl2?6H2O,易潮解,置于干燥空氣中會風(fēng)化而失去結(jié)晶水,若在空氣中加熱MgCl2?6H2O,生成的是Mg(OH)Cl或MgO。次氯酸鈉與二氧化碳反應(yīng)產(chǎn)生的次氯酸是漂白劑的有效成分。氯仿(CHCl3)常因保存不慎而被氧化,產(chǎn)生劇毒物光氣(COCl2)
下列說法正確的是( )A.CHCl3、COCl2分子中所有原子的最外層電子都滿足8電子穩(wěn)定結(jié)構(gòu) B.COCl2、CO2都是由極性鍵構(gòu)成的非極性分子 C.氯原子基態(tài)核外電子排布式為3s23p5 D.ⅦA族元素單質(zhì)的晶體類型相同,沸點(diǎn):HF>HCl 組卷:3引用:0難度:0.60
二.非選擇題:共4題,共61分。
-
16.KIO3是常見的食鹽加碘劑,某小組制備KIO3晶體的流程如圖1,請回答下列問題:
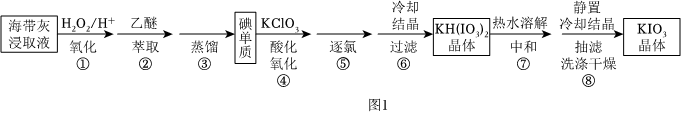
已知:①碘易溶于乙醚;乙醚微溶于水,沸點(diǎn):34.5℃,密度:0.714g/cm-3,易燃。
②KIO3在水中的溶解度:20℃為8.1g,80℃為21.8g;KIO3難溶于乙醇。
③5I-++6H+=3I2+3H2OI2+2S2IO-3═2I-+S4O2-3。O2-6
(1)步驟①“氧化”的離子方程式:。
(2)步驟②進(jìn)行萃取操作時,需要放氣,圖2中正確的放氣圖示是(填標(biāo)號)。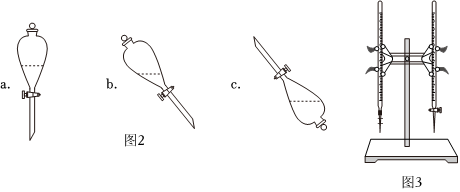
(3)步驟④用帶磁力攪拌的電熱套控溫85℃加熱約1h,判斷氧化反應(yīng)已完全的方法是。
(4)步驟⑧后,往濾液中加入一定量,再次抽濾,可提高產(chǎn)品收率。
(5)生產(chǎn)中,如果省去“酸化”、“逐氯”、“冷卻結(jié)晶、過濾”這三步操作,直接用KOH溶液“中和”調(diào)整反應(yīng)后溶液的pH,會導(dǎo)致產(chǎn)品碘酸鉀中混有含碘元素的物質(zhì),化學(xué)式為。
(6)為了測定KIO3產(chǎn)品的純度,可采用碘量法滴定。請補(bǔ)充完整實(shí)驗(yàn)方案:
①準(zhǔn)確稱取1.000g產(chǎn)品,配制成250mL溶液;
②按規(guī)定操作分別將0.1000mol?L-1 Na2S2O3標(biāo)準(zhǔn)溶液和待測KIO3溶液裝入如圖3所示的滴定管中;③。
(實(shí)驗(yàn)中須使用的試劑有稀硫酸溶液、KI溶液、淀粉指示劑)。組卷:16引用:2難度:0.7 -
17.Ⅰ.已知:①NaHCO3(s)=Na+(aq)+
(aq) ΔH=+18.81kJ?mol-1HCO-3
②Na2CO3(s)=2Na+(aq)+(aq) ΔH=-16.44kJ?mol-1CO2-3
③2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(l) ΔH=+92.34kJ?mol-1
請回答:
(1)資料顯示,NaHCO3固體加熱到100℃發(fā)生分解,但是加熱NaHCO3溶液不到80℃就有大量CO2氣體放出,用反應(yīng)熱角度說明原因。
(2)NaHCO3溶液中主要存在2種化學(xué)平衡:
a.+H2O?H2CO3+OH-;HCO-3
b.2?HCO-3+H2O+CO2。CO2-3
根據(jù)理論計算0.10mol?L-1NaHCO3溶液中2個反應(yīng)的轉(zhuǎn)化率隨溫度變化如圖1所示(不考慮相互影響):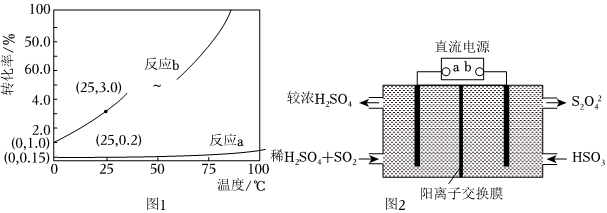
計算25℃0.10mol?L-1NaHCO3溶液中CO2與H2CO3的總濃度最大可能為mol?L-1
Ⅱ.SO2和NOx都是大氣污染物
(1)利用圖2所示裝置(電極均為惰性電極)也可吸收SO2,并用陰極排出的溶液吸收NO2。b極的電極反應(yīng)式為。
(2)其他條件相同,以一定流速分別向含催化劑A和B的反應(yīng)管中通入一定比例O2、NH3、NO和N2的模擬煙氣,測得NO的去除率與溫度的關(guān)系如題圖3所示。使用催化劑B,當(dāng)溫度高于360℃,NO的去除率下降的原因是。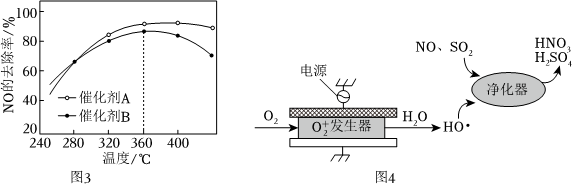
(3)O2在一定條件下能有效去除煙氣中的SO2、NO,可能的反應(yīng)機(jī)理如圖4所示,該過程可描述為。組卷:13引用:2難度:0.5


