2021-2022學(xué)年湖北省襄陽市棗陽一中高二(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。每小題只有一個選項(xiàng)符合題意。
-
1.為了更好的解決能源問題,人們一方面研究如何提高燃料的燃燒效率,另一方面尋找新能源.以下做法不能提高燃料效率的是
( )A.煤的汽化與液化 B.液體燃料呈霧狀噴出 C.通入大大過量的空氣 D.將煤粉粉碎 組卷:164引用:12難度:0.9 -
2.下列圖象分別表示有關(guān)反應(yīng)的反應(yīng)過程與能量變化的關(guān)系,據(jù)此判斷下列說法中正確的是( )
A. 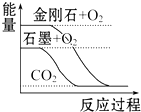
石墨轉(zhuǎn)變?yōu)榻饎偸俏鼰岱磻?yīng)B. 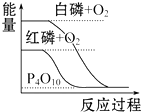
白磷比紅磷穩(wěn)定C. 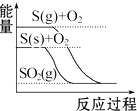
S(g)+O2(g)═SO2(g)△H1
S(s)+O2(g)═SO2(g)△H2 則△H1>△H2D. 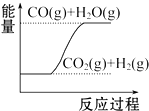
CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0組卷:42引用:24難度:0.9 -
3.下列說法正確的是( )
A.活化分子之間的碰撞一定是有效碰撞 B.任何有能量變化的過程都是化學(xué)變化過程 C.放熱反應(yīng)在任何條件下都容易自發(fā)進(jìn)行,而吸熱反應(yīng)在任何條件下都不容易自發(fā)進(jìn)行 D.升高溫度、增加反應(yīng)物的濃度和使用催化劑都能增加單位體積內(nèi)活化分子數(shù)目,加快化學(xué)反應(yīng)速率 組卷:1引用:2難度:0.7 -
4.已知反應(yīng)熱:
①25℃、101 kPa時,2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1
弱電解質(zhì)電離時吸熱。下列結(jié)論正確的是( )A.C的燃燒熱大于110.5kJ?mol-1 B.①的反應(yīng)熱為221kJ?mol-1 C.濃硫酸與NaOH溶液反應(yīng)的中和熱為-57.3kJ?mol-1 D.稀醋酸與稀NaOH溶液反應(yīng)生成1mol水,放出57.3kJ熱量 組卷:8引用:2難度:0.7 -
5.已知25℃時有關(guān)弱酸的電離平衡常數(shù):則下列有關(guān)說法正確的是( )
弱酸化學(xué)式 CH3COOH HCN H2CO3 電離平衡常數(shù) 1.8×10-5 4.9×10-10 K1=4.3×l0-7
K2=5.6×l0-11A.稀釋HCN溶液過程中, 減小c(CN-)c(HCN)B.醋酸溶液加水稀釋,其電離程度先增大后減小 C.NaCN中通入少量CO2發(fā)生的化學(xué)反應(yīng)為:NaCN+CO2+H2O═HCN+NaHCO3 D.等物質(zhì)的量濃度的各溶液pH關(guān)系為:pH(CH3COOH)>pH(H2CO3)>pH(HCN) 組卷:15引用:1難度:0.7 -
6.下列實(shí)驗(yàn)事實(shí)不能用勒夏特列原理解釋的是( )
A.唾液可以使淀粉水解速率加快 B.紅棕色的NO2氣體加壓后顏色先變深后變淺 C.高壓比常壓有利于合成SO3的反應(yīng) D.黃綠色的氯水光照后顏色變淺 組卷:19引用:5難度:0.7
二、非選擇題:本題共5小題,共55分。
-
 19.工業(yè)上可用H2和CO2制備甲醇,其反應(yīng)方程式為CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某溫度下,將1mol CO2和3mol H2充入體積不變的2L密閉容器中,發(fā)生上述反應(yīng),測得不同時刻反應(yīng)前后的壓強(qiáng)關(guān)系如表:
19.工業(yè)上可用H2和CO2制備甲醇,其反應(yīng)方程式為CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某溫度下,將1mol CO2和3mol H2充入體積不變的2L密閉容器中,發(fā)生上述反應(yīng),測得不同時刻反應(yīng)前后的壓強(qiáng)關(guān)系如表:
(1)用H2表示前2h的平均反應(yīng)速率v(H2)=時間/h 1 2 3 4 5 6 ρ后ρ前0.90 0.85 0.83 0.81 0.80 0.80 。
(2)該溫度下,CO2的平衡轉(zhuǎn)化率為。
(3)在溫度為T,壓強(qiáng)為P的條件下,將CO2和H2按物質(zhì)的量之比1:3通入一恒壓密閉容器中發(fā)生上述反應(yīng),達(dá)到平衡時,測得CO2的平衡轉(zhuǎn)化率為50%,則該反應(yīng)條件下的平衡常數(shù)為Kp=(用含P的表達(dá)式表示,其中用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
(4)CO2經(jīng)催化加氫可合成低碳烯烴:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H。在0.1MPa時,按n(CO2):n(H2)=1:3投料,如圖所示為不同溫度(T)下,平衡時四種氣態(tài)物質(zhì)的物質(zhì)的量(n)關(guān)系。
①該反應(yīng)的△H0(填“>”或“<”)。
②曲線c表示的物質(zhì)為。
③為提高H2的平衡轉(zhuǎn)化率,除改變溫度外,還可采取的措施是(答出一條即可)。組卷:12引用:3難度:0.5 -
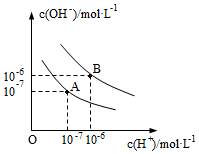 20.已知水在25℃和95℃時的電離平衡曲線如圖所示。
20.已知水在25℃和95℃時的電離平衡曲線如圖所示。
(1)25℃時水的電離平衡曲線應(yīng)為(填“A”或“B”)。其理由是。
(2)95℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比。
(3)25℃時,等體積的pH=12的NaOH溶液和氨水分別與0.1mol/L的鹽酸發(fā)生中和反應(yīng)時,恰好完全反應(yīng)時消耗鹽酸的體積(填:“前者多”或“后者多”或“一樣多”)。
(4)95℃時,某溶液由水電離出H+的濃度為10-8,則該溶液的pH=。
(5)在一定溫度下,有以下三種酸:a.醋酸;b.硫酸;c.鹽酸
①當(dāng)三種酸物質(zhì)的量濃度相同時,三種溶液中水的電離程度由大到小的順序是(用a、b、c表示,下同)。
②當(dāng)三種酸的PH相同、體積相同時,分別加入足量的鋅,產(chǎn)生H2的體積(相同狀況)由大到小的順序?yàn)?。組卷:80引用:4難度:0.7


