2022年江蘇省高考化學考前打靶試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括14小題,每小題3分,共計42分。每小題只有一個選項符合題意。
-
1.漂白粉加水浸泡時發生反應:Ca(ClO)2+CO2+H2O=CaCO3+2HClO。下列說法正確的是( )
A.該反應屬于氧化還原反應 B.漂白粉的主要成分為Ca(ClO)2 C.CO2屬于電解質 D.酸性比較:H2CO3>HClO 組卷:26引用:1難度:0.8 -
2.在照相底片的定影過程中,常用反應AgBr+2Na2S2O3=Na[Ag(S2O3)2]+NaBr溶解未曝光的AgBr。下列說法正確的是( )
A.中子數為16的硫原子:32S B.Na+的結構示意圖: 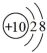
C.Na3[Ag(S2O3)2]的外界為[Ag(S2O3)2]3- D.NaBr的電子式: 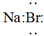 組卷:15引用:1難度:0.6
組卷:15引用:1難度:0.6 -
3.下列制取NH4HCO3的實驗原理與裝置能達到實驗目的的是( )
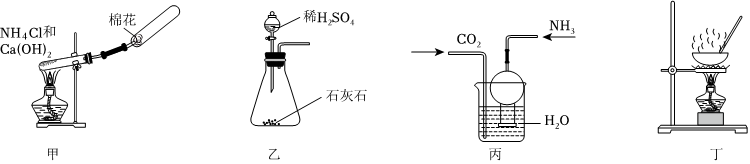
A.用裝置甲制取NH3 B.用裝置乙制取CO2 C.用裝置丙制取NH4HCO3溶液 D.用裝置丁獲得NH4HCO3固體 組卷:82引用:3難度:0.5 -
4.X、Y、Z、M是四種原子序數依次增大的短周期主族元素,基態時Z原子2p原子軌道上有1對成對電子,且X、Y、Z、M形成的化合物Q如圖。下列說法錯誤的是( )
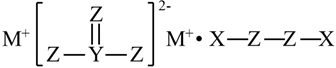
A.原子半徑:r(M)>r(Y)>r(Z)>r(X) B.Z的簡單氣態氫化物的沸點比Y的高 C.Z與M的單質化合形成的物質可能含有共價鍵 D.化合物Q有較強的氧化性且在高溫下穩定 組卷:21引用:2難度:0.5 -
5.下列關于鐵及其化合物的性質與用途,不具有對應關系的是( )
A.Fe具有還原性,可用作食品抗氧化劑 B.Fe2O3屬于堿性氧化物,可用作粉刷墻壁的紅色涂料 C.Fe3O4具有磁性,可用作激光打印機墨粉的添加劑 D.Fe(OH)3膠體具有吸附性,可用作自來水廠的凈水劑 組卷:72引用:2難度:0.7 -
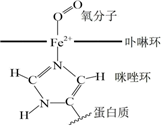 6.鐵元素是重要的金屬元素,含有鐵元素的物質,在人類的生產生活中有著重要的應用。Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g) ΔH<0 是煉鐵工業中的主反應。在血液中,O2 的輸送與血紅蛋白中的Fe2+有關。血紅蛋白分子的結構如圖,下列有關說法正確的是( )
6.鐵元素是重要的金屬元素,含有鐵元素的物質,在人類的生產生活中有著重要的應用。Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g) ΔH<0 是煉鐵工業中的主反應。在血液中,O2 的輸送與血紅蛋白中的Fe2+有關。血紅蛋白分子的結構如圖,下列有關說法正確的是( )A.O2通過配位鍵與Fe2+相連 B.Fe2+的基態價電子排布式為3d44s2 C.咪唑環中所有原子均在同一平面上 D.該結構中,O元素的第一電離能最大 組卷:20引用:2難度:0.8
二.非選擇題
-
17.以方鉛礦(主要成分為PbS,含有FeS2等雜質)為原料制備PbSO4并測定含量。
步驟Ⅰ:浸取。將方鉛礦、軟錳礦(主要成分為MnO2)和鹽酸、氯化鈉在如圖所示裝置中反應。反應結束后過濾。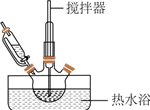
步驟Ⅱ:調pH。取濾液加入MnO,調節pH,過濾得濾渣和濾液(主要含Na+、Ca2+、Pb2+、Mn2+、Cl-等)。
步驟Ⅲ:制備PbSO4。
步驟Ⅳ:測定PbSO4含量。
已知:a.PbCl2難溶于冷水,易溶于熱水
b.PbCl2(s)+2Cl-(aq)=PbCl42-(aq)ΔH>0
c.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-3
(1)①“浸取”時生成PbCl2和S的化學方程式為。
②“浸取”時加入氯化鈉的目的是。
③“浸取”速率隨反應進行會變慢,除反應物濃度減小的原因外,還可能為。
(2)“調pH”時得到的濾渣的成分為。
(3)制備PbSO4。請補充實驗方案:取調pH后的溶液,,干燥,得PbSO4晶體。(須選用的試劑:1mol?L-1H2SO4溶液、冷水、AgNO3溶液)
(4)測定PbSO4含量的方法如下:取PbSO4晶體0.4000g,加入堿性0.1000mol?L-1EDTA溶液26.00mL,再用0.1000mol?L-1ZnSO4溶液滴定過量的EDTA至終點,消耗ZnSO4溶液14.00mL(已知Pb2+、Zn2+與EDTA反應的化學計量比均為1:1)。計算PbSO4含量(寫出計算過程)。組卷:18引用:1難度:0.7 -
18.含氮化合物(NOx、NO3-等)是主要的污染物之一,消除含氮化合物的污染倍受關注。
(1)NH3還原技術是當今最有效、最成熟的去除NOx的技術之一、使用V2O5/(TiO2-SiO2)催化劑能有效脫除電廠煙氣中氮氧化物,發生脫硝主要反應為:4NO+4NH3+O2=4N2+6H2O。
①V的基態核外電子排布式為。
②以相同的氣體流速、=1.2條件下,NO轉化率隨溫度變化如圖1所示。隨溫度升高,NO轉化率先升高后降低的可能原因是n(NH3)n(NO)。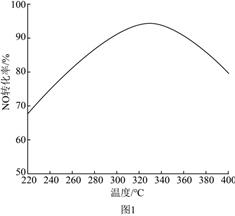
③除去NO反應過程中提高氣體流速可提高催化劑的利用率,降低成本。氣體流速對與NO轉化率的關系如圖2所示。為合理利用催化劑應選擇/h的流速;隨氣體流速增大,NO轉化率下降的原因為。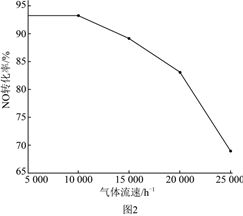
(2)一種電解法處理含有NO3-的酸性廢水的工作原理如圖3所示,陰極和陽極之間用浸有NaCl溶液的多孔無紡布分隔。陽極材料為石墨,陰極材料中含有鐵的化合物,H表示氫原子。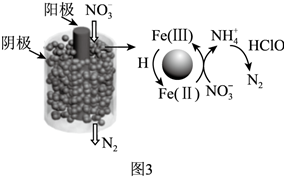
電解法處理含有NO3-的酸性廢水的過程可描述為,NH4+與HClO反應生成N2。NH4+與HClO反應的離子方程式為。組卷:41引用:1難度:0.7


