2022-2023學年河南省南陽市宛城區高二(上)月考化學試卷(10月份)
發布:2024/8/2 8:0:9
一、第I卷選擇題(共48分)
-
1.全球氣候變化是21世紀人類面臨的重大挑戰。世界各國以全球協約的方式減排溫室氣體,我國由此提出2030年前碳達峰的承諾。為實現這一承諾,濮陽人也在行動,包括燒烤和打燒餅的已用天然氣或者液化石油氣代替了焦炭或木炭。以下關于能源說法正確的是( )
A.用天然氣代替煤炭或木炭做燃料可以實現碳的零排放 B.氫能、風能、天然氣、海洋能、生物質能它們資源豐富,可以再生,沒有污染或者很少污染,很可能成為未來的主要能源 C.天然氣水合物主要成分是甲烷水合物,其組成可表示為CH4?nH2O,具有可燃性,被認為是21世紀的高效清潔能源 D.為了實現我國關于碳達峰與碳中和的承諾,應該立刻禁止使用煤炭與石油做燃料 組卷:31引用:4難度:0.7 -
2.下列說法不正確的是( )
A.反應4Fe(OH)2(s)+2H2O(1)+O2(g)═4Fe(OH)3(s)常溫下能自發進行,該反應的ΔH<0 B.反應H2S(g)+ZnO(s)═H2O(g)+ZnS(s)在一定條件下可自發進行,且ΔS<0,則ΔH>0 C.反應3C(s)+CaO(s)═CaC2(s)+CO(g)在常溫下不能自發進行,說明該反應的ΔH>0 D.SiO2(s)+2C(s)═Si(s)+2CO(g)必須在高溫下反應才能發生,則ΔH>0 組卷:10引用:2難度:0.8 -
3.用如圖甲所示裝置及試劑進行鐵的電化學腐蝕實驗探究,測定具支錐形瓶中壓強(p)隨時間變化關系以及溶解氧(DO)隨時間變化關系的曲線如圖乙和丙所示,下列說法不正確的是( )
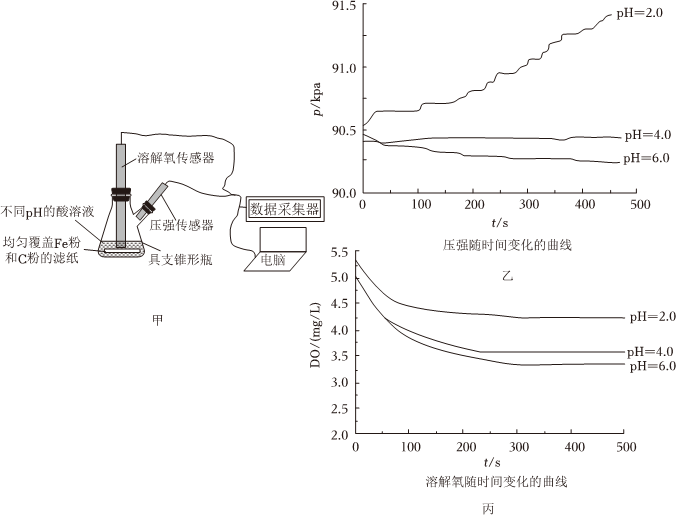
A.整個過程中,負極電極反應式均為Fe-2e-═Fe2+ B.pH=2.0時,壓強增大主要是因為產生了H2 C.pH=4.0時,不發生析氫腐蝕,只發生吸氧腐蝕 D.pH=6.0時,正極電極反應式為O2+4e-+2H2O═4OH- 組卷:31引用:3難度:0.7 -
4.NO2中存在下列平衡:2NO2?N2O4(g)(正反應是放熱反應).在測定NO2的相對分子質量時,下列條件中較為適宜的是( )
A.溫度130℃,壓強3.03×105 Pa B.溫度25℃,壓強1.01×105 Pa C.溫度130℃,壓強5.05×104 Pa D.溫度0℃,壓強5.05×104 Pa 組卷:273引用:11難度:0.7 -
5.在一恒溫恒容的密閉容器中放入一定量的液體W,發生反應W(l)?P(g)+2Q(g)△H。以下說法:①v正(P)=v逆(Q);②Q的體積分數保持不變;③容器內氣體密度保持不變;④氣體的平均相對分子質量保持不變;⑤△H保持不變;⑥c(P):c(Q)=1:2;⑦容器中壓強保持不變;⑧平衡常數保持不變;⑨W的質量保持不變;其中可以作為該反應達到平衡狀態的判斷依據的有( )
A.5個 B.4個 C.3個 D.2個 組卷:83引用:4難度:0.6 -
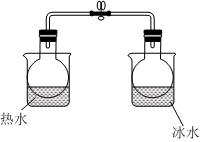 6.下列化學事實中,不能用勒夏特列原理解釋的是( )
6.下列化學事實中,不能用勒夏特列原理解釋的是( )A.向NaOH固體中滴入濃氨水可制取少量NH3 B.浸泡在熱水中的NO2球比浸泡在冰水中的顏色深(如圖) C.將O2通過放電管在較高壓強下制取O3[反應為3O2(g)═2O3(g)] D.對于平衡體系CO(g)+Cl2(g)═COCl2(g,無色),縮小體積氣體顏色比原平衡深 組卷:6引用:2難度:0.5 -
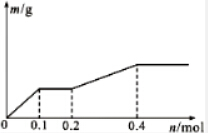 7.用Pt電極電解含有Ag+、Cu2+和X3+各0.1mol的溶液,陰極析出固體物質的質量m(g)與回路中通過電子的物質的量n(mol)的關系如圖所示.則下列氧化性強弱的判斷正確的是( )
7.用Pt電極電解含有Ag+、Cu2+和X3+各0.1mol的溶液,陰極析出固體物質的質量m(g)與回路中通過電子的物質的量n(mol)的關系如圖所示.則下列氧化性強弱的判斷正確的是( )A.Ag+>X3+>Cu2+>H+>X2+ B.Ag+>Cu2+>X3+>H+>X2+ C.Cu2+>X3+>Ag+>X2+>H+ D.Cu2+>Ag+>X3+>H+>X2+ 組卷:349引用:13難度:0.7
二、第II卷非選擇題(共52分)
-
20.苯催化加氫制備環己烷是化工生產中的重要工藝,一定條件下,發生如下反應:
Ⅰ:主反應: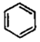 (g)+3H2(g)?
(g)+3H2(g)?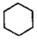 (g)△H1<0
(g)△H1<0
Ⅱ:副反應: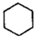 (g)?
(g)?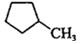 (g)△H2>0
(g)△H2>0
回答下列問題:
(1)已知:Ⅲ:2H2(g)+O2(g)=2H2O(l)△H3
Ⅳ:2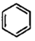 (g)+15O2(g)?12CO2(g)+6H2O(l)△H4
(g)+15O2(g)?12CO2(g)+6H2O(l)△H4
Ⅴ: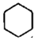 (g)+9O2(g)=6CO2(g)+6H2O(l)△H5
(g)+9O2(g)=6CO2(g)+6H2O(l)△H5
則△H1=(用△H3、△H4和△H5表示)。
(2)有利于提高平衡體系中環己烷體積分數的措施有。
A.適當升溫
B.適當降溫
C.適當加壓
D.使用高效催化劑
(3)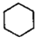 和
和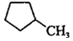 的燃燒熱較大的是 。
的燃燒熱較大的是 。
(4)反應Ⅰ在管式反應器中進行,實際投料往往在n(H2):n(C6H6)=3:1的基礎上適當增大H2用量,其目的是。
(5)氫原子和苯分子吸附在催化劑表面活性中心時,才能發生反應,機理如圖。下列說法不正確的是。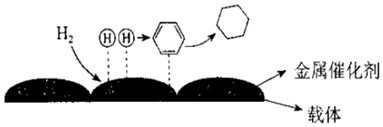
A.此反應(苯催化加氫制備環己烷)的原子利用率為100%
B.反應過程中,有H-H、C=C鍵的斷裂和C-H鍵的生成
C.載體可以增大金屬催化劑的表面積,提高催化效率
D.該催化劑可有效提高反應物的平衡轉化率
(6)當H2中混有微量H2S或CO等雜質時,會導致反應Ⅰ的產率降低,推測其可能原因為。組卷:8引用:2難度:0.5 -
21.2021年3月全國兩會期間,政府工作報告中提到的“碳達峰”“碳中和”成為熱詞。“碳中和”指的是測算在一定時間內直接或間接產生的二氧化碳或溫室氣體排放總量,通過植樹造林、節能減排等形式,抵消自身產生的二氧化碳排放,實現二氧化碳的“零排放”。溫室氣體二氧化碳與氫氣反應制備燃料甲醇的技術,能促進“碳中和”。請完成下列問題:CO2加氫制甲醇的總反應可表示為:CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=?kJ?mol-1
該反應一般認為通過如下步驟來實現:
①CO2(g)+H2(g)?CO(g)+H2O(g) ΔH1=+42kJ?mol-1
②2CO(g)+2H2(g)?CH3OH(g) ΔH2=-90kJ?mol-1
(1)總反應的ΔH=kJ?mol-1;若反應①為慢反應,如圖1示意圖中能體現上述反應能量變化的是(填標號)。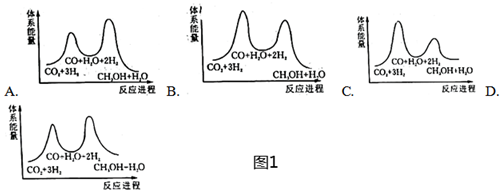
(2)合成總反應在起始物=3時,在不同條件下達到平衡,設體系中甲醇的物質的量分數為x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如圖2所示。n(H2)n(CO2)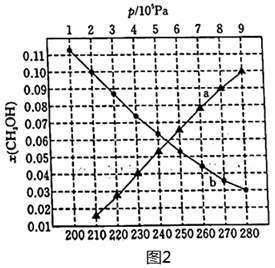
①圖中對應等溫過程的曲線是,判斷的理由是。
②當x(CH3OH)=0.10時,CO2的平衡轉化率α=(保留三位有效數字),反應條件可能為或。組卷:26引用:2難度:0.5


