2020-2021學年山東省濟南外國語學校高三(下)月考化學試卷(3月份)
發布:2024/4/20 14:35:0
一、單選題(共10小題,滿分30分)
-
1.分子式為C3H4Cl2的鏈狀化合物(包括順反異構)有( )
A.5種 B.6種 C.7種 D.8種 組卷:45引用:1難度:0.8 -
2.下列有關溶液(室溫下)的說法正確的是( )
A.Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] B.0.10mol?L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) C.物質的量濃度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小關系:④>①>②>③ D.0.10mol?L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) 組卷:172引用:3難度:0.5 -
 3.兩體積相同的密閉容器中均充入1mol X和1mol Y,分別于300℃和500℃開始發生反應:X(g)+Y(g)?3Z(g).Z的含量(Z%)隨時間t的變化如圖所示.已知在t3時刻改變了某一實驗條件.相關判斷正確的是( )
3.兩體積相同的密閉容器中均充入1mol X和1mol Y,分別于300℃和500℃開始發生反應:X(g)+Y(g)?3Z(g).Z的含量(Z%)隨時間t的變化如圖所示.已知在t3時刻改變了某一實驗條件.相關判斷正確的是( )A.曲線a是500℃時的圖象 B.t3時刻可能是降低了溫度 C.正反應是吸熱反應 D.t3時刻可能是增大了壓強 組卷:30引用:6難度:0.7 -
4.中學化學中很多“規律”都有其適用范圍,下列根據有關“規律”推出的結論正確的是( )
選項 規律 結論 A 溶解度小的沉淀易向溶解度更小的沉淀轉化 ZnS 沉淀中滴加CuSO4 溶液可以得到CuS 沉淀 B 較強酸可以制取較弱酸 次氯酸溶液無法制取鹽酸 C 反應物濃度越大,反應速率越快 常溫下,相同的鋁片中分別加入足量的濃、稀硝酸,濃硝酸中鋁片先溶解完 D 結構和組成相似的物質,沸點隨相對分子質量增大而升高 NH3的沸點低于PH3 A.A B.B C.C D.D 組卷:22引用:2難度:0.7 -
5.已知下列四組實驗:
①向KMnO4晶體上滴加濃鹽酸,產生氯氣;
②向FeCl2溶液中通入少量氯氣,溶液變黃色;
③向FeCl2溶液中加入少量溴水,溶液變黃色;
④分別取實驗②和實驗③中生成的溶液,分別滴在淀粉KI試紙上,試紙都變藍色.
則下列判斷不正確的是( )A.實驗①能夠證明Cl-具有還原性 B.上述實驗能夠證明氧化性:Cl2>Br2 C.上述實驗能夠證明氧化性: >Cl2>Fe3+>I2MnO-4D.由上述實驗不能判斷氯氣能使濕潤的淀粉KI試紙變藍 組卷:138引用:3難度:0.7 -
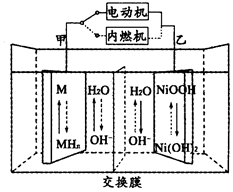 6.第三代混合動力車,可以用電動機、內燃機或二者結合推動車輛。汽車上坡或加速時,電動機提供推動力,降低汽油的消耗;在剎車或下坡時,電池處于充電狀態,其電路工作原理如圖所示,下列說法中正確的是( )
6.第三代混合動力車,可以用電動機、內燃機或二者結合推動車輛。汽車上坡或加速時,電動機提供推動力,降低汽油的消耗;在剎車或下坡時,電池處于充電狀態,其電路工作原理如圖所示,下列說法中正確的是( )A.放電時乙為正極,充電時乙為陰極 B.汽車上坡時發生圖中虛線所示的過程 C.放電時負極的電極反應式為:MHn-ne-═M+nH+ D.電池充電時,OH-由甲側向乙側移動 組卷:67引用:4難度:0.7
三、填空題(共5小題,每小題10分,滿分50分)
-
19.毒重石的主要成分為BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2?2H2O的流程如下:

(1)毒重石用鹽酸浸取前需充分研磨,目的是增大接觸面積從而。
(2)加入NH3?H2O調節pH=8可除去(填離子符號),此時,溶液中該離子的濃度為mol?L-1。再加入NaOH調pH=12.5,溶液內剩余的陽離子中完全沉淀,部分沉淀(填離子符號)。加入H2C2O4時應避免過量,原因是。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Fe(OH)3]=2.6×10-39。
(3)由于Na2S2O5具有毒性,因此國家對其在食品中的用量有嚴格的規定。某化學興趣小組在測定某白葡萄酒中Na2S2O5的殘留量時,取40mL葡萄酒樣品于錐形瓶中,滴入幾滴淀粉溶液,用0.02mol?L-1碘的標準溶液滴定至終點,消耗碘標準溶液5mL,則滴定終點的現象為Ca2+ Mg2+ Fe3+ 開始沉淀時的pH 11.9 9.1 1.9 完全沉淀時的pH 13.9 11.1 3.2 ,Na2S2O5的含量是以SO2來計算的,則該樣品中Na2S2O5的殘留量以SO2計為g/L。組卷:20引用:1難度:0.6 -
 20.氧化亞氮(N2O)是一種強溫室氣體,且易轉換成顆粒污染物。研究氧化亞氮分解對環境保護有重要意義。
20.氧化亞氮(N2O)是一種強溫室氣體,且易轉換成顆粒污染物。研究氧化亞氮分解對環境保護有重要意義。
(1)污水生物脫氮過程中,在異養微生物催化下,硝酸銨可分解為N2O和另一種產物,該反應的化學方程式為。
(2)已知反應2N2O(g)=2N2(g)+O2(g)的△H=-163kJ?mol-1,1molN2(g)、1molO2(g)分子中化學鍵斷裂時分別需要吸收945kJ、498kJ的能量,則1molN2O(g)分子中化學鍵斷裂時需要吸收的能量為kJ。
(3)在一定溫度下的恒容容器中,反應2N2O(g)=2N2(g)+O2(g)的部分實驗數據如下:
①在0~20min時段,反應速率v(N2O)為反應時間/min 0 10 20 30 40 50 60 70 80 90 100 c(N2O)/mol?L-1 0.100 0.090 0.080 0.070 0.060 0.050 0.040 0.030 0.020 0.010 0.010 mol?L-1?min-1。
②若N2O起始濃度c0為0.150mol?L-1,則反應至30min時N2O的轉化率α=。比較不同起始濃度時N2O的分解速率:v(c0=0.150mol?L-1)v(c0=0.100mol?L-1)(填“>”、“=”或“<”)。
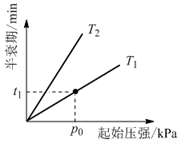
③不同溫度(T)下,N2O分解半衰期隨起始壓強的變化關系如圖所示(圖中半衰期指任一濃度N2O消耗一半時所需的相應時間),則T1T2(填“>”、“=”或“<”)。當溫度為T1、起始壓強為p0,反應至t1 min時,體系壓強p=(用p0表示)。
(4)碘蒸氣存在能大幅度提高N2O的分解速率,反應歷程為:
第一步 I2(g)?2I(g) (快反應)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反應)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反應)
實驗表明,含碘時N2O分解速率方程v=k?c(N2O)?[c(I2)]0.5(k為速率常數)。下列表述正確的是(填標號)。
A.N2O分解反應中,k(含碘)>k(無碘)
B.第一步對總反應速率起決定作用
C.第二步活化能比第三步大
D.I2濃度與N2O分解速率無關組卷:83引用:6難度:0.9


