2022-2023學(xué)年吉林省長春外國語學(xué)校高二(上)第一次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.由X、Y轉(zhuǎn)化為M的反應(yīng)歷程如圖所示,下列說法正確的是( )
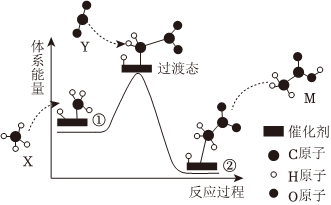
A.①→②的總過程吸熱 B.M是CH3COOH C.反應(yīng)過程中形成C-H鍵 D.催化劑使ΔH降低 組卷:44引用:3難度:0.8 -
2.已知反應(yīng):I2(g)+H2(g)?2HI(g) ΔH=-9.48kJ?mol-1。下列說法正確的是( )
A.1molI2(g)和1molH2(g)的總能量低于2molHI(g)的能量 B.反應(yīng)Cl2(g)+H2(g)=2HCl(g) ΔH=-QkJ?mol-1,Q>9.48 C.向一密閉容器中充入1molI2(g)和1molH2(g),充分反應(yīng)后,放出9.48kJ的能量 D.?dāng)嗔?molI2(g)和1molH2(g)的化學(xué)鍵需要的能量大于斷裂2molHI(g)的化學(xué)鍵需要的能量 組卷:22引用:3難度:0.7 -
3.活潑自由基與氧氣的反應(yīng) 一直是科學(xué)家關(guān)注的熱點(diǎn)。HNO自由基與O2反應(yīng)過程的能量變化如圖所示,下列說法錯(cuò)誤的是( )

A.該反應(yīng)為放熱反應(yīng) B.產(chǎn)物的穩(wěn)定性:P1<P2 C.該歷程中最大正反應(yīng)的活化能E正=186.19kJ?mol-1 D.相同條件下,由中間產(chǎn)物Z轉(zhuǎn)化為產(chǎn)物的速率:v(P1)<v(P2) 組卷:43引用:8難度:0.5 -
4.圖象可直觀地表現(xiàn)化學(xué)變化中的物質(zhì)變化和能量變化。下列判斷錯(cuò)誤的是( )
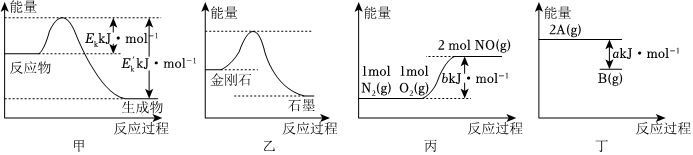
A.圖甲所示反應(yīng)為放熱反應(yīng)。且ΔH=(Ek-Ek′)kJ?mol-1 B.已知石墨比金剛石穩(wěn)定,則金剛石轉(zhuǎn)化為石墨過程中的能量變化如圖乙 C.圖丙所示反應(yīng)的熱化學(xué)方程式為N2(g)+O2(g)═2NO(g)ΔH=-bkJ?mol-1 D.若2A(g)?B(g)的能量變化如圖丁,則2A(g)?B(1)ΔH=-akJ?mol-1 組卷:71引用:4難度:0.7 -
5.下列熱化學(xué)方程式中,正確的是( )
A.甲烷燃燒熱為890.3kJ?mol-1,熱化學(xué)方程式為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=+890.3kJ?mol-1 B.稀鹽酸和稀氫氧化鈉溶液混合,其熱化學(xué)方程式為:H++OH-=H2O ΔH=-57.3kJ?mol-1 C.C(石墨,s)=C(金剛石,s) ΔH>0,說明石墨比金剛石穩(wěn)定 D.500℃、30MPa下,將0.5molN2和1.5molH2置于密閉的容器中充分反應(yīng)生成NH3(g),放熱19.3kJ,其熱化學(xué)方程式為:N2(g)+3H2(g) 2NH3(g)ΔH=-38.6kJ?mol-1催化劑500℃/30MPa組卷:55引用:3難度:0.5 -
6.給定物質(zhì)A、B、C的量,在一定條件下發(fā)生反應(yīng),建立如下化學(xué)平衡:aA(g)+bB(g)=xC(g),符合圖所示的關(guān)系(c%表示平衡混合氣中產(chǎn)物C的百分含量。T表示溫度,P表示壓強(qiáng))。在圖中,Y軸是指( )
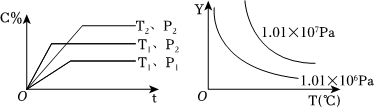
A.反應(yīng)物A的百分含量 B.平衡混合氣的總物質(zhì)的量 C. 比值n(B)n(C)D.反應(yīng)物B的平衡轉(zhuǎn)化率 組卷:54引用:4難度:0.7
二、填空題:本題共4小題,共52分。
-
19.研究含氮、硫物質(zhì)之間的轉(zhuǎn)化,對(duì)資源的綜合利用具有重要意義。
(1)硫酸生產(chǎn)中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g)ΔH=-196.6kJ?mol-1
①在恒容密閉容器中達(dá)到平衡后,能使平衡正向移動(dòng)并提高SO2轉(zhuǎn)化率的是。
A.向容器中通入O2
B.向容器中通入SO2
C.使用催化劑
D.降低溫度
②如圖1表示SO2催化氧化生成SO3在密閉容器中達(dá)到平衡時(shí),由于條件改變而引起反應(yīng)速率的變化情況,a時(shí)刻改變的條件可能是;若c時(shí)刻增大壓強(qiáng),把反應(yīng)速率變化情況畫在c~d處。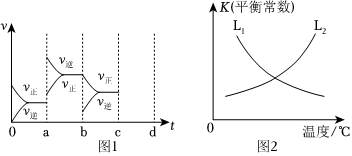
(2)合成氨反應(yīng)N2(g)+3H2(g)?2NH3(g)ΔH<0是人工固氮的主要手段,對(duì)人類生存和經(jīng)濟(jì)發(fā)展都有著重大意義。合成氨反應(yīng)中正反應(yīng)速率v正=k正c(N2)?c3(H2),逆反應(yīng)速率v逆=k逆c2(NH3)。k正、k逆為速率常數(shù)。平衡常數(shù)K與溫度的關(guān)系如圖2。
①表示正反應(yīng)的平衡常數(shù)K與溫度變化的曲線為(填L1或L2)。
②平衡時(shí),合成氨反應(yīng)的平衡常數(shù)K=(用k正、k逆表示)。
(3)將一定量N2O4氣體充入恒容的密閉容器中,控制反應(yīng)溫度為T1,發(fā)生的反應(yīng)為:N2O4(g)?2NO2(g)ΔH>0。
①下列可作為反應(yīng)達(dá)到平衡的判據(jù)是。
A.V正(N2O4)=2v逆(NO2)
B.氣體的壓強(qiáng)不變
C.ΔH不變
D.容器內(nèi)顏色不變
②時(shí)刻反應(yīng)達(dá)到平衡,混合氣體平衡總壓強(qiáng)為P,N2O4的平衡轉(zhuǎn)化率為80%,則反應(yīng)N2O4(g)?2NO2(g)的平衡常數(shù)Kp=(用平衡分壓代替平衡濃度,分壓=總壓×物質(zhì)的量分?jǐn)?shù))。組卷:36引用:3難度:0.6 -
20.乙烷裂解制乙烯具有成本低。收率高、投資少、污染小等優(yōu)點(diǎn)。目前裂解方法有電催化、光催化裂解、直接裂解、氧氣或二氧化碳氧化乙烷裂解等。回答下列問題:
(1)乙烷直接裂解時(shí)溫度、壓強(qiáng)及平衡轉(zhuǎn)化率的關(guān)系如圖1所示: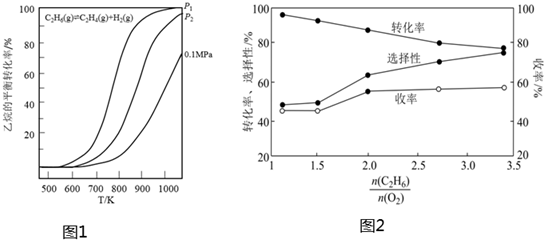
反應(yīng)的ΔH0,p1p2(填“>”、“<”或“=”)。
(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反應(yīng)如下:
(Ⅰ) C2H6(g)?C2H4(g)+H2(g) ΔH1
(Ⅱ) CO2(g)+C2H6(g)?C2H4(g)+CO(g)+H2O(g) ΔH2
(Ⅲ) 2C2H6(g)+O2(g)?2C2H4(g)+2H2O(g) ΔH3
①反應(yīng)(Ⅰ)、(Ⅱ)的平衡常數(shù)分別為K1、K2,則反應(yīng)CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常數(shù)為K=(用含K1、K2的代數(shù)式表示)。
②上述反應(yīng)體系在一定條件下建立平衡后,下列說法正確的有。
A.加入反應(yīng)(Ⅰ)的催化劑,可降低反應(yīng)的焓變
B.恒壓摻入Ar能提高反應(yīng)(Ⅱ)的平衡產(chǎn)率
C.降低溫度,反應(yīng)(Ⅲ)的正反應(yīng)速率降低、逆反應(yīng)速率增大
D.增加乙烷的濃度,反應(yīng)(Ⅰ) (Ⅱ)(Ⅲ)的平衡均向右移動(dòng)
③在800°C時(shí)發(fā)生反應(yīng)(Ⅲ),乙烷的轉(zhuǎn)化率、乙烯的選擇性和收率隨投料比的變化關(guān)系如圖2所示,控制n(C2H6)n(O2)=2,而不采用選擇性更高的n(C2H6)n(O2)=3.5,除可防止積碳外,另一原因是n(C2H6)n(O2);<2時(shí),n(C2H6)n(O2)越小,乙烷的轉(zhuǎn)化率越大,乙烯的選擇性和收率越小的原因是n(C2H6)n(O2)。組卷:8引用:1難度:0.6


