2021年江蘇省蘇錫常鎮四市高考化學二模試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括13小題,每小題3分,共計39分。每小題只有一個選項最符合題意。
-
1.化學與生活、環境和生產密切相關。下列敘述不涉及氧化還原反應的是( )
A.使用添加氟化物牙膏預防齲齒 B.綠化造林助力實現碳中和目標 C.用氯化鐵溶液制作銅印刷電路板 D.用ClO2泡騰片殺滅新型冠狀病毒 組卷:66引用:3難度:0.8 -
2.工業上制備保險粉的反應為HCOONa+NaOH+2SO2═Na2S2O4+CO2+H2O。下列有關說法正確的是( )
A.Na+的結構示意圖為 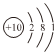
B.NaOH的電子式為 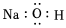
C.HCOONa中含有σ鍵和π鍵的數目之比為3:1 D.基態S原子核外價電子的軌道表達式為 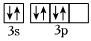 組卷:38引用:6難度:0.7
組卷:38引用:6難度:0.7 -
3.酸在生產、實驗中有廣泛應用。下列有關酸的性質與用途具有對應關系的是( )
A.氫氟酸顯弱酸性,可用于雕刻玻璃 B.濃鹽酸具有揮發性,可用于除去鐵銹 C.濃硫酸有強氧化性,實驗室可用于與甲酸反應制取CO D.硝酸有強氧化性,能溶解Ag等不活潑金屬用于貴重金屬的提煉 組卷:25引用:1難度:0.6 -
4.請閱讀下列材料,回答4~6題:燃煤和工業生產中產生的SO2過量排放會形成酸雨。SO2是重要的化工原料,可作漂白劑。在接觸法制硫酸的工業中,SO2發生的反應為:2SO2(g)+O2(g)═2SO3(g)△H=-198kJ?mol-1。
下列關于SO2的說法正確的是( )A.SO2分子呈直線形,是非極性分子 B.SO2的水溶液能導電,SO2是電解質 C.SO2和H2S反應,每生成1molS,轉移的電子數為2mol D.用石灰石漿液吸收煙氣中的SO2,可減少酸雨的形成,最終轉化為石膏 組卷:24引用:0難度:0.50 -
5.請閱讀下列材料,回答4~6題:燃煤和工業生產中產生的SO2過量排放會形成酸雨。SO2是重要的化工原料,可作漂白劑。在接觸法制硫酸的工業中,SO2發生的反應為:2SO2(g)+O2(g)═2SO3(g)△H=-198kJ?mol-1。
用下列裝置進行SO2制取、性質驗證和尾氣處理,其中不能實現相應實驗目的的是( )A. 
制取B. 
驗證其還原性C. 
驗證其漂白性D. 
尾氣處理組卷:29引用:0難度:0.60
二、非選擇題:共4題,共61分。
-
16.葡萄糖酸鋅是一種抗缺鋅藥物,可由ZnSO4?7H2O為原料制得。工業上以廢鋅鐵合金(主要成分為Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等雜質)為原料制備ZnSO4?7H2O的流程如圖。

(1)堿洗的目的是。
(2)氧化時發生反應的離子方程式為。
(3)取“氧化”過程中的上層清液,滴加酸性KMnO4稀溶液,紫紅色褪去,可能的原因是。
(4)由過濾所得的濾液為原料制備ZnSO4?7H2O,請補充完整相應的實驗方案:向濾液中,過濾、晾干,得到ZnSO4?7H2O。實驗中須用到的試劑:鋅粉、1.0mol?L-1H2SO4。
(5)以ZnSO4?7H2O為原料可制得葡萄糖酸鋅[Zn(C6H11O7)2]。為測定葡萄糖酸鋅樣品的純度,進行下列實驗。
步驟1:稱取5.200g樣品溶于水配成100mL溶液,取25.00mL置于錐形瓶中,滴入少量的鉻黑T作指示劑。
步驟2:向錐形瓶中加入過量的10.00mL 2.000mol?L-1EDTA,振蕩。
步驟3:用1.000mol?L-1鋅標準溶液滴定過量的EDTA至終點,消耗鋅標準溶液16.00mL(已知:Zn2+與EDTA反應的化學計量比為1:1)。
①計算此產品中鋅元素的質量分數:。(寫出計算過程)
②Zn(C6H11O7)2中鋅元素的含量為14.28%,對照①計算結果,產生誤差的可能原因是(所有測定操作均正確)。組卷:51引用:1難度:0.5 -
17.As(0)、As(Ⅲ)和As(Ⅴ)分別表示砷單質、三價砷和五價砷的化合物。硫酸廠產生的酸性廢水中含有超標的H3AsO3,需處理達標后才能排放。目前含砷廢水的處理常用石灰中和-PFS、氧化吸附、納米級零價鐵等方法。
(1)石灰中和-PFS法,處理過程如下:
含砷廢水經氧化后,加入石灰乳,在相同時間內,廢水中沉降的固體、砷的去除率與溶液pH的關系如圖1所示。H3AsO4水溶液中含砷微粒的物質的量分布分數與pH的關系如圖2所示。已知此溫度下,Ca(H2AsO4)2溶于水,Ksp(FeAsO4)=5.7×10-21,Ksp[Ca3(AsO4)2]=6.8×10-19,Ksp(CaHAsO4)=8.4×10-4。
①一級沉降時,當pH=2,廢水中開始產生沉淀,該沉淀主要成分的化學式為。pH調節到8時,開始產生Ca3(AsO4)2沉淀,原因是。
②二級沉降中,保持溶液pH在8~10之間。加入PFS(聚合硫酸鐵,[Fe2(OH)2n(SO4)3-n]m)形成的Fe(OH)3膠體粒子與含砷微粒反應可提高砷的去除率,其主要反應的離子方程式為.
(2)氧化吸附法:新生態MnO2懸濁液具有較強的氧化性,能將As(Ⅲ)氧化為As(Ⅴ),也具有較強的吸附性,能吸附水體中的H+而帶正電荷。所帶正電荷越多,吸附含砷微粒的能力越強。pH不同時,新生態MnO2懸濁液對砷去除率如圖3所示。
①加入新生態MnO2懸濁液使廢水中H3AsO3轉化為H3AsO4,反應的離子方程式為。
②pH從3增大到7的過程中,隨著pH增大,砷的去除率上升。其原因是。
(3)納米級零價鐵法:納米級零價鐵具有強吸附性和還原性,可直接處理有氧條件下含As(Ⅲ)較多的廢水。處理后在納米級零價鐵表面有大量的As(0),外圍有大量的As(Ⅴ)。產生As(0)的原理如圖4所示。請描述產生As(0)、As(Ⅴ)的過程:。 組卷:41引用:1難度:0.3
組卷:41引用:1難度:0.3


