2020-2021學年天津三中高三(下)段考化學試卷(2月份)
發布:2024/4/20 14:35:0
一、單選題(共12題,每題3分,共36分)
-
1.在全國人民眾志成城抗擊新冠病毒期間,使用的“84消毒液”的主要有效成分是( )
A.NaOH B.NaCl C.NaClO D.Na2CO3 組卷:568引用:22難度:0.7 -
2.下列說法正確的是( )
A.可用金屬鈉除去乙醇溶液中的水 B.萃取碘水中的碘單質,可用乙醇做萃取劑 C.我國西周時發明的“酒曲”釀酒工藝,是利用了催化劑使平衡正向移動的原理 D.汽油中加入適量乙醇作汽車燃料,可節省石油資源,減少汽車尾氣對空氣的污染 組卷:60引用:2難度:0.6 -
3.下列離子方程式書寫正確的是( )
A.CaCO3與稀硝酸反應:CO32-+2H+═H2O+CO2↑ B.FeSO4溶液與溴水反應:2Fe2++Br2═2Fe3++2Br- C.NaOH溶液與過量H2C2O4溶液反應:H2C2O4+2OH-═C2O42-+2H2O D.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O═2C6H5OH+CO32- 組卷:1329引用:4難度:0.5 -
4.已知下表中幾種物質的熔、沸點:
據此判斷,下列說法錯誤的是( )NaCl KBr AlCl3 單質X SiCl4 熔點/℃ 801 730 190 2 300 -70 沸點/℃ 1 413 1 380 180 2 500 53 A.AlCl3晶體加熱易升華 B.SiCl4是分子晶體 C.單質X可能是原子晶體 D.AlCl3是原子晶體 組卷:46引用:2難度:0.6 -
5.下列實驗儀器或裝置的選擇正確的是( )
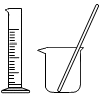

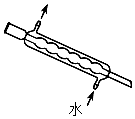
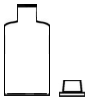
配制50.00mL 0.1000mol?L-1Na2CO3溶液 除去Cl2中的HCl 蒸餾用冷凝管 盛裝Na2SiO3溶液的試劑瓶 A B C D A.A B.B C.C D.D 組卷:623引用:19難度:0.5
二、非選擇題(共4題,共64分)
-
15.廢舊印刷電路板是一種電子廢棄物,其中銅的含量達到礦石中的幾十倍.濕法技術是將粉碎的印刷電路板經溶解、萃取、電解等操作得到純銅等產品.某化學小組模擬該方法回收銅和制取膽礬,流程簡圖1如下:

(1)反應Ⅰ是將Cu轉化為Cu(NH3)42+,反應中H2O2的作用是.操作①的名稱:.
(2)反應Ⅱ是銅氨溶液中的Cu(NH3)42+與有機物RH反應,寫出該反應的離子方程式:.操作②用到的主要儀器名稱為,其目的是(填序號).
a.富集銅元素 b.使銅元素與水溶液中的物質分離 c.增加Cu2+在水中的溶解度
(3)反應Ⅲ是有機溶液中的CuR2與稀硫酸反應生成CuSO4和.若操作③使用圖2裝置,圖中存在的錯誤是.
(4)操作④以石墨作電極電解CuSO4溶液.陰極析出銅,陽極產物是.操作⑤由硫酸銅溶液制膽礬的主要步驟是.
(5)流程中有三處實現了試劑的循環使用,已用虛線標出兩處,第三處的試劑是.
循環使用的NH4Cl在反應Ⅰ中的主要作用是.組卷:250引用:10難度:0.3 -
16.偏二甲肼(C2H8N2)、肼(N2H4)和四氧化二氮(N2O4)可作為運載火箭的推進劑。
(1)已知:C2H8N2(l)+4O2(g)═N2(g)+4H2O(g)+2CO2(g)ΔH1
N2(g)+2O2(g)═2NO2(g)ΔH2
2NO2 (g)?N2O4(l)ΔH3
C2H8N2(l)和N2O4(l)反應生成N2(g)、CO2(g)和H2O(g)并放出大量熱,寫出該反應的熱化學方程式(ΔH用含ΔH1、ΔH2、ΔH3的代數式表示)。
該反應(填“是”或“不是”)自發反應,判斷的理由是。
(2)肼(N2H4)也可用于新型環保燃料電池中,燃料電池的工作原理示意圖如圖1所示,該燃料電池的負極反應式為。
(3)將4mol N2O4放入2L恒容密閉容器中發生反應N2O4(g)?2NO2(g),平衡體系中N2O4的體積分數(φ)隨溫度的變化如圖2所示:
①D點v(正)v(逆)(填“>”“=”或“<”)。
②A、B、C點中平衡常數K的值最大的是點。
T2時,N2O4的平衡轉化率為;若達平衡時間為5s,則此時間內的N2O4平均反應速率為。
③若其他條件不變,在T3原平衡基礎上,再加入一定量NO2,達到新平衡時,與原平衡相比,NO2的體積分數(填“增大”“不變”或“減小”)。組卷:35引用:3難度:0.5


