2020年天津市和平區高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.“筆、墨、紙、硯”在中國傳統文化中被稱為“文房四寶”,下列說法中不正確的是( )
A B C D 



用灼燒法可鑒別毛筆羊毫的真偽 用墨寫字畫畫可長久不褪色 紙及造紙原料的主要成分均是纖維素 用石材制作硯臺的過程是化學變化 A.A B.B C.C D.D 組卷:172引用:9難度:0.9 -
2.下列關于有機物的說法不正確的是( )
A.正丁烷和異丁烷的沸點相同 B.麥芽糖的水解產物只有葡萄糖 C.疫苗冷藏存放的目的是避免蛋白質變性 D.苯與乙烯均可以使溴水褪色,但褪色原理不同 組卷:198引用:3難度:0.8 -
3.下列說法正確的是( )
A.將SO2通入品紅溶液中證明SO2具有漂白性 B.將鐵屑放入稀HNO3中證明Fe比H2活潑 C.將澄清石灰水滴入某溶液證明其中存在CO32- D.將少量溴水滴入過量的苯酚溶液中有白色沉淀生成 組卷:96引用:2難度:0.6 -
4.在乙烯分子中有5個σ鍵、一個π鍵,它們分別是( )
A.未雜化的sp2軌道形成σ鍵、雜化的2p軌道形成π鍵 B.雜化的sp2軌道形成π鍵、未雜化的2p軌道形成σ鍵 C.C-H之間是sp2形成的σ鍵,C-C之間有未參加雜化的2p軌道形成的π鍵 D.C-C之間是sp2形成的σ鍵,C-H之間有未參加雜化的2p軌道形成的π鍵 組卷:133引用:1難度:0.8 -
5.下列實驗中,對應的現象以及結論都正確且兩者具有因果關系的是( )
選項 實驗 現象 結論 A 向發黃的濃硝酸中通入O2 黃色褪去 濃硝酸中混有Fe3+ B 向無色溶液中滴加FeCl3溶液和CCl4,振蕩、靜置 下層顯紫紅色 原溶液中含有I- C 向無水乙醇中加入濃H2SO4,加熱至170℃,產生的氣體通入酸性KMnO4溶液 紫紅色褪去 乙醇發生了消去反應
D向濃度均為0.1mol?L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 出現黃色沉淀 Ksp(AgCl)<Ksp(AgI) A.A B.B C.C D.D 組卷:97引用:3難度:0.5
二、解答題(共4小題,滿分64分)
-
15.化工原料水合肼(N2H4?H2O)是一種強還原性的堿性液體。
Ⅰ.實驗室用圖裝置制備水合肼(N2H4?H2O)。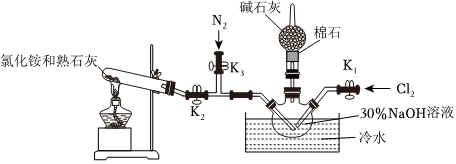
實驗步驟:①關閉K2、K3,打開K1,制備 NaClO;②關閉K1、K2,打開K3,通入N2一段時間;③關閉K3,打開K2,點燃酒精燈。回答下列問題:
(1)盛放堿石灰的儀器的名稱為。
(2)配制30% NaOH溶液時,所需玻璃儀器有燒杯、玻璃棒、膠頭滴管和。
(3)步驟2中通入N2一段時間的原因是。
(4)水槽中放入冷水的目的是。
(5)NH3與 NaClO反應生成N2H4?H2O的化學方程式為。
Ⅱ.已知:N2H4?H2O+2I2═N2↑+4HI+H2O,測定水合肼粗產品的純度步驟如下:
a.稱取N2H4?H2O粗產品(其它雜質不與I2反應)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于錐形瓶中,滴加幾滴淀粉溶液。
d.用0.3000mol?L-1的碘標準溶液進行滴定。
e.重復上述操作兩次。三次測定數據如表:
f.數據處理。實驗序號 1 2 3 消耗碘標準溶體積/mL 20.24 20.02 19.98
(6)碘標準溶液盛放在(填“酸式”或“堿式”)滴定管中。在滴定管中裝入碘標準溶液的前一步,應進行的操作為,達到終點的現象是。
(7)消耗的碘標準溶液平均體積為mL,粗產品中水合肼的質量分數為。
(8)判斷下列操作對測定結果的影響(填“偏高”、“偏低”或“無影響”)。
①若在配制碘標準溶液時,燒杯中的溶液有少量濺出,則測定結果。
②若在滴定終點讀取滴定管刻度時,俯視標準液液面,則測定結果。組卷:152引用:3難度:0.5 -
16.合理控制、利用燃煤排放的CO2、SO2、CO是優化環境的有效途徑。
(1)CO2生產甲醇方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ?mol-1;
已知:2H2(g)+O2(g)═2H2O(g)△H=-bkJ?mol-1;
H2O(g)═H2O(l)△H=-ckJ?mol-1;
CH3OH(g)═CH3OH(l)△H=-dkJ?mol-1。
則表示CH3OH(l)燃燒熱的熱化學方程式為。
(2)工業生產中用SO2為原料制取硫酸
①利用原電池將SO2轉化法,如圖(a)所示,則負極的電極反應式為。
②電解Na2SO3溶液吸收SO2得到的NaHSO3法,如圖(b)所示,則陽極反應式。
(3)光氣(COCl2)是一種重要的化工原料,工業上通過Cl2(g)+CO(g)?COCl2(g)的反應制備。根據圖(c)、圖(d),回答下列問題: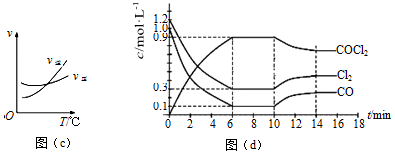
①該反應的正反應是熱反應(填“放”或“吸”)。
②0~6min內,反應的平均速率v(Cl2)=;該溫度下的平衡常數為。
③若恒溫恒容時,在第7min向體系中加入這三種物質各2mol,則平衡移動(填“向左”、“向右”或“不”)。
④若恒溫恒壓時,初始投料濃度為c(Cl2)=0.7mol?L-1、c(CO)=0.5mol?L-1、c(COCl2)=mol?L-1,最終達到化學平衡時,Cl2的體積分數與上述第6min時的相同。
⑤第nmin反應溫度表示為T(n),則:T(8)T(15)(填“>”、“<”或“=”)。組卷:102引用:1難度:0.4


