2021-2022學(xué)年福建省龍巖市六縣一中高二(上)期中化學(xué)試卷
發(fā)布:2024/12/29 22:30:3
一.選擇題、本題共10小題,每小題4分,共40分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),下列說法錯(cuò)誤的是( )
A.燃煤時(shí)鼓入過量的空氣可以減少酸雨的產(chǎn)生 B.新能源汽車的推廣與使用,有利于減少光化學(xué)煙霧的產(chǎn)生 C.加活性炭吸附水中的小顆粒物,該凈化水質(zhì)的過程屬于物理變化 D.可燃冰開發(fā)不當(dāng)釋放出的甲烷會(huì)加劇溫室效應(yīng) 組卷:2引用:3難度:0.8 -
2.已知下列反應(yīng):O2(g)+C(s)?CO2(g) K1;2C(s)+O2(g)?2CO(g) K2。則反應(yīng):2CO(g)+O2(g)?2CO2(g)的平衡常數(shù)為( )
A. K21K12B.2K1-K2 C. ×K2K21D.2K1+K2 組卷:110引用:13難度:0.5 -
3.如圖所示裝置中,能形成原電池且溶液會(huì)變藍(lán)的是( )
A. 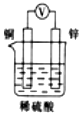
B. 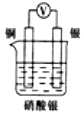
C. 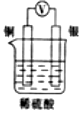
D. 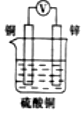 組卷:26引用:3難度:0.5
組卷:26引用:3難度:0.5 -
4.反應(yīng)C(s)+H2O(g)?CO(g)+H2(g)在一可變?nèi)莘e的密閉容器中進(jìn)行,下列條件的改變對(duì)其反應(yīng)速率幾乎無影響的是( )
①增加C的量
②將容器的體積縮小一半
③保持體積不變,充入N2使體系壓強(qiáng)增大
④保持壓強(qiáng)不變,充入N2使容器體積變大。A.①④ B.②③ C.①③ D.②④ 組卷:996引用:58難度:0.7 -
5.某反應(yīng)過程中的能量變化如圖所示,下列熱化學(xué)方程式正確的是( )

A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-(a+c-b-d)kJ?mol-1 B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-(b+d-a-c)kJ?mol-1 C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-(a+2c-b-2d)kJ?mol-1 D.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-(b+2d-a-2c)kJ?mol-1 組卷:26引用:5難度:0.9
二、解答題
-
14.某化學(xué)興趣小組進(jìn)行了實(shí)驗(yàn):向2支試管中分別加入0.5gNa2CO3固體和0.5 gNaHCO3固體,再分別加入30mL0.3mol?L-1鹽酸,充分反應(yīng)后,用手觸摸試管,明顯感覺到加Na2CO3固體的試管變熱了,加NaHCO3固體的試管變冷了。甲同學(xué)由此得出結(jié)論:
(aq)+2H+ (aq)=H2O(l)+CO2(g) ΔH1<0,CO2-3(aq)+H+ (aq)=H2O(l)+CO2(g) ΔH2>0。HCO-3
回答下列問題:
(1)乙同學(xué)認(rèn)為該實(shí)驗(yàn)不一定能得到甲同學(xué)的結(jié)論,你支持誰的觀點(diǎn)?(填“甲”或“乙”),理由是。
(2)查閱資料:
反應(yīng)Ⅰ:(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1=-12.14kJ?mol-1;CO2-3
反應(yīng)Ⅱ:(aq)+H+(aq)=H2O(l)+CO2(g) ΔH2=+12.64 kJ?mol-1HCO-3
則反應(yīng)Ⅲ:(aq)+H+(aq)=CO2-3(aq) ΔH3=HCO-3kJ?mol-1。向VmLc mol?L-1碳酸鈉溶液中,逐滴加入2VmLcmol?L-1稀鹽酸。下列圖像中,能正確表示該反應(yīng)過程中的能量變化的是(填標(biāo)號(hào))。
(3)該化學(xué)興趣小組用如圖所示裝置設(shè)計(jì)了實(shí)驗(yàn),驗(yàn)證碳酸鈉、碳酸氫鈉分別與稀鹽酸反應(yīng)的熱效應(yīng)。
表格一:
表格二:試劑1 試劑2混合前溫度/℃ 混合后溫度/℃ 0.5gNa2CO3 40mLHCl19.0 21.7 0.5gNaHCO3 40 mLHCl19.0 18.1
表格三:試劑1 試劑2混合
前溫度/℃溶解后
溫度/℃靜置后的
溫度/℃試劑3混合
前溫度/℃混合后
溫度/℃0.5gNa2CO3 10mLH2O19.0 22.3 19.0 10mLH2O19.0 19.0 0.5gNaHCO3 10mLH2O19.0 17.5 19.0 10mLH2O19.0 19.0
實(shí)驗(yàn)操作::將試劑1與試劑2混合,測(cè)混合后溶液的溫度,靜置,冷卻至定溫,再將試劑3與之前的混合溶液混合,再測(cè)混合溶液的溫度。試劑1 試劑2混合
前溫度/℃溶解后
溫度/℃靜置后的
溫度/℃試劑3混合
前溫度/℃混合后
溫度/℃0.5gNa2CO3 10mLH2O19.0 22.3 19.0 10mLHCl19.0 20.5 0.5gNaHCO3 10mLH2O19.0 17.5 19.0 10mLHCl19.0 18.3
①實(shí)驗(yàn)中玻璃攪拌器的使用方法是。
②表格二對(duì)應(yīng)實(shí)驗(yàn)得出的結(jié)論是。
③反應(yīng)IV:Na2CO3(s)+2H+ (aq)=2Na+ (aq)+H2O(l)+CO2(g) ΔH4;反應(yīng)V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5。則ΔH1(填“>”、“<”或“=”,下同) ΔH4,ΔH2ΔH5。組卷:5引用:1難度:0.7 -
15.工業(yè)上用二氧化碳催化加氫可合成乙醇,其反應(yīng)原理為2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)△H。
(1)該反應(yīng)的△H(填“>”、“<”或“=”)0;其正反應(yīng)在(填“高溫”、“低溫”或“任何溫度”)下能自發(fā)進(jìn)行。
(2)該反應(yīng)的反應(yīng)速率表達(dá)式為v正=k正?c2(CO2)?c6(H2),v逆=k逆?c(C2H5OH)?c3(H2O),其中k正、k逆為速率常數(shù)。則該反應(yīng)的平衡常數(shù)K=(用含k正、k逆的代數(shù)式表示),若其他條件不變,降低溫度,則下列推斷合理的是(填標(biāo)號(hào))。
a.k正增大,k逆減小
b.k正減小,k逆增大
c.k正減小的倍數(shù)大于k逆
d.k正減小的倍數(shù)小于k逆
(3)恒溫時(shí),向一密閉容器中充入2molCO2和6molH2,發(fā)生上述反應(yīng),H2的平衡轉(zhuǎn)化率(α)與壓強(qiáng)的關(guān)系如圖所示。
①此溫度下,該反應(yīng)的平衡常數(shù)KP=MPa-4(氣體的分壓=氣體總壓強(qiáng)×氣體的物質(zhì)的量分?jǐn)?shù))。
②x=,設(shè)A點(diǎn)時(shí)容器的體積為V1,B點(diǎn)時(shí)容器的體積為V2,則V1:V2=。組卷:26引用:4難度:0.5


