2022年山東省煙臺市高考化學三模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分.每小題只有一個選項符合題意.
-
1.化學與生活、科技密切相關,下列說法錯誤的是( )
A.量子通信材料螺旋碳納米管與石墨互為同素異形體 B.我國北斗導航衛星的芯片與光導纖維的主要成分相同 C.新冠疫苗在常溫下失效的原因是蛋白質變性 D.中科院首創二氧化碳加氫制汽油在山東成功量產,可減緩能源危機 組卷:32引用:2難度:0.6 -
2.利用如圖裝置(夾持裝置略)進行實驗,能達到實驗目的的是( )
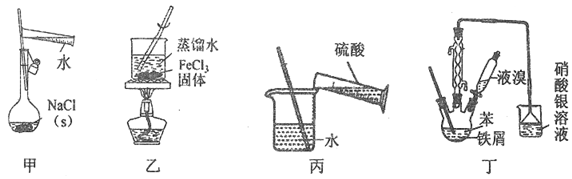
A.用甲裝置配制0.1mol?L-1NaCl溶液 B.用乙裝置制備少量的Fe(OH)3膠體 C.用丙裝置稀釋濃硫酸 D.用丁裝置證明苯與溴發生取代反應 組卷:28引用:2難度:0.5 -
3.下列有關化學用語表示正確的是( )
A.NaClO的電子式: 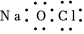
B.C原子的一種激發態: 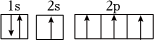
C.O2-的結構示意圖: 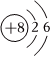
D.K+的基態電子排布式:1s22s22p63s23p64s2 組卷:166引用:5難度:0.7 -
4.下列實驗操作、現象及結論均正確的是( )
A.向Na2S溶液中通入足量SO2,生成淡黃色沉淀,證明SO2具有氧化性 B.向淀粉水解溶液中滴加少量新制Cu(OH)2懸濁液,加熱無磚紅色沉淀,證明淀粉未水解 C.向丙烯醇中滴加酸性KMnO4溶液,溶液褪色,證明丙烯醇中含有碳碳雙鍵 D.某溶液中加入鹽酸,生成使澄清石灰水變渾濁的氣體,則溶液中一定含有CO32-或HCO3- 組卷:18引用:2難度:0.5 -
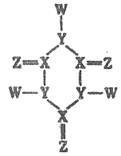 5.W、X、Y、Z是原子序數依次增大的短周期元素,Y的氣態氫化物與其最高價氧化物對應的水化物反應生成鹽,由四種元素組成的某化合物結構式如圖,X、Y、Z均達到8電子穩定結構。下列說法錯誤的是( )
5.W、X、Y、Z是原子序數依次增大的短周期元素,Y的氣態氫化物與其最高價氧化物對應的水化物反應生成鹽,由四種元素組成的某化合物結構式如圖,X、Y、Z均達到8電子穩定結構。下列說法錯誤的是( )A.最高價氧化物對應的水化物酸性:X<Y B.Z的離子半徑一定小于Y的離子半徑 C.四種元素中電負性最小的是W D.X能與W元素組成非極性分子 組卷:41引用:2難度:0.5 -
 6.科學家發明了一種新型的制氫技術,其工作原理如圖。在催化劑的作用下葡萄糖降解為小分子,小分子在電解過程中轉化為CO2,下列說法正確的是( )
6.科學家發明了一種新型的制氫技術,其工作原理如圖。在催化劑的作用下葡萄糖降解為小分子,小分子在電解過程中轉化為CO2,下列說法正確的是( )A.M電極上小分子物質得電子發生還原反應 B.電解池中使用陰離子交換膜 C.N極發生的電極反應式:2H++2e-=H2↑ D.標準狀況下,在陰極生成22.4LH2時,消耗15g葡萄糖 組卷:76引用:3難度:0.5
三、非選擇題:本題共5小題,共60分.
-
19.SO2易溶于水、乙醇和乙醚,常用作漂白劑和還原劑,SO2在酸性條件下還原性較差,堿性條件下較強.某實驗小組用如圖裝置制備SO2并探究其性質.回答下列問題:

(1)裝置B中濃硫酸的作用是;實驗中觀察到:裝置C中溶液紅色沒有褪去,裝置D中溶液紅色褪去.由此可得出的結論是。
(2)為了進一步探究使品紅褪色的主要微粒,進行如下系列實驗:
綜合上述實驗推知,SO2水溶液使品紅褪色時起主要作用的微粒是實驗 試管中的溶液 滴入溶液 實驗現象 a 2mL0.1mol?L-1SO2溶液(pH=2) 各滴入1滴0.1%品紅溶液 溶液變紅逐漸變淺,約90s后完全褪色 b 2mL0.1mol?L-1NaHSO3溶液(pH=5) 溶液變紅后立即變淺,約15s后完全褪色 c 2mL0.1mol?L-1Na2SO3溶液(pH=10) 溶液變紅后立即褪色 (填微粒符號)。
(3)用15mL1mol?L-1CuCl2溶液和35mL1mol?L-1NaOH溶液制備Cu(OH)2懸濁液,實驗中觀察到:裝置E中生成大量白色沉淀,溶液呈綠色,與CuSO4溶液、CuCl2溶液的顏色明顯不同。
①為探究白色沉淀的成分,查閱資料如下:CuCl為白色固體,難溶于水,能溶于濃鹽酸,與氨水反應生成[Cu(NH3)2]+,在空氣中立即被氧化成含有藍色[Cu(NH3)4]2+的溶液。
甲同學向洗滌后的白色沉淀中加入氨水,得到藍色溶液,此過程中反應的離子方程式為CuCl+2NH3?H2O=[Cu(NH3)2]++Cl-+2H2O、。
乙同學設計一個簡單實驗方案證明白色沉淀為CuCl:;裝置E中生成白色沉淀的離子方程式為。
②為探究E中溶液呈綠色而不是藍色的原因,向4mL1mol?L-1CuSO4溶液中通入過量SO2,未見溶液顏色發生變化,目的是;取少量E中濾液,加入少量稀鹽酸,產生無色刺激性氣味氣體,得到澄清藍色溶液,故推斷溶液顯綠色的原因可能是溶液中含有較多Cu(HSO3)2.為進一步實驗確認這種可能性,向少量1mol?L-1CuSO4溶液中加入(填化學式),得到綠色溶液。組卷:76引用:2難度:0.5 -
20.含氮污染物的有效去除和資源的充分利用是重要研究課題,回答下列問題:
(1)利用工業尾氣NO2與O3反應制備新型硝化劑N2O5,過程中涉及以下反應:
Ⅰ.2O3(g)?3O2(g)ΔH1平衡常數K1
Ⅱ.4NO2(g)+O2(g)?2N2O5(g)ΔH2平衡常數K2
Ⅲ.2NO2(g)+O3(g)?N2O5(g)+O2(g)ΔH3平衡常數K3
平衡常數K與溫度T的函數關系為lnK1=x+34159/T,lnK2=y+15372/T,lnK3=z+24765/T,其中x、y、z為常數,則反應Ⅰ的活化能Ea(正)Ea(逆)(填“>”或“<”),的數值范圍是ΔH2ΔH3.
(2)NH3與O2作用分別生成N2、NO、N2O的反應均為放熱反應.工業尾氣中的NH3可通過催化氧化為N2除去.將一定比例的NH3、O2和N2的混合氣體以一定流速通過裝有催化劑的反應管,NH3的轉化率、N2的選擇在與溫度的關系如圖所示.[2n(N2)n(NH3)×100%]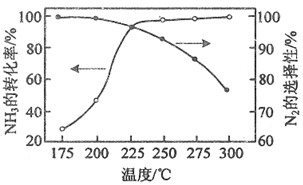
①其他條件不變,在175~300℃范圍內升高溫度,出口處氮氧化物的量(填“增大”或減小”),NH3的平衡轉化率(填“增大”或“減小”).
②需研發(“高溫”或“低溫”)下N2的選擇性高的催化劑,能更有效除去尾氣中的NH3.
(3)在催化劑條件下發生反應:2NO(g)+2CO(g)N2(g)+2CO2(g)可消除NO和CO對環境的污染.為探究溫度對該反應的影響,實驗初始時體系中氣體分壓p(NO)=p(CO)且p(CO2)=2p(N2),測得反應體系中CO和N2的分壓隨時間變化情況如表所示.
該反應的ΔH時間/min 0 30 60 120 180 200℃ 物質a的分壓/kPa 4 8.8 13 20 20 物質b的分壓/kPa 48 45.6 43.5 40 40 300℃ 物質a的分壓/kPa 100 69.0 48 48 48 物質b的分壓/kPa 10 25.5 36 36 36 0(填“>”或“<”),物質a為(填“CO”或N2”),200℃該反應的化學平衡常數Kp=(kPa)-1..組卷:38引用:2難度:0.6


