2021-2022學年江蘇省常州市前黃中學高三(上)月考化學試卷(一)
發布:2024/4/20 14:35:0
一、選擇題:本題包括14小題,每小題3分,共42分。每題有一個選項符合題意。
-
1.我國力爭在2030年前碳達峰,2060年前實現碳中和。化學在致力“碳達峰、碳中和”方面發揮著巨大作用。下列措施不利于實現上述目標的是( )
A.燃油汽車使用尾氣催化轉化裝置 B.汽油中添加乙醇 C.“禁塑令”頒布有利于減少CO2排放 D.加強新能源汽車推廣使用 組卷:12引用:3難度:0.6 -
2.將適量NaHCO3粉末投入飽和氯水中,能增加溶液中HClO的濃度,其反應原理為NaHCO3+Cl2=NaCl+CO2↑+HClO。下列化學用語表示正確的是( )
A.CO2的電子式: 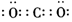
B.HClO的結構式:H-Cl-O C.NaHCO3的電離方程式:NaHCO3?Na++H++CO32- D.NaHCO3溶液顯堿性:HCO3-+H2O?H3O++CO32- 組卷:11引用:4難度:0.4 -
3.1935年,在中國化學家侯德榜的領導下,中國建成了第一座生產合成氨、硝酸等的聯合企業——永利制堿廠。該企業首先合成氨,氨再經鉑銠催化劑催化氧化得到NO,將NO、水和空氣通入吸收塔中得到硝酸。氨催化氧化法制取NO的反應為:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.8kJ/mol。下列關于工業上由氨氣制取濃硝酸的過程說法正確的是( )
A.NH3的空間構型為平面三角形 B.催化氧化法制取NO過程中,升高溫度,可以增大該反應的平衡常數 C.反應中每消耗22.4L(標準狀況) NH3可放出熱量226.45kJ D.4mol NH3(g)和5mol O2(g)所含能量總和比4mol NO(g)和6mol H2O(g)的總能量小 組卷:14引用:2難度:0.7 -
4.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.20g D218O含有的中子數目為10NA B.0.1mol/L NaHSO4溶液中含有的H+數目為0.1NA C.2mol NO與1mol O2在密閉容器中充分反應后的分子數為2NA D.標況下11.2L CO2與足量Na2O2反應轉移電子數目0.5NA 組卷:26引用:2難度:0.5 -
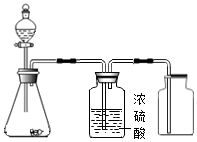 5.在實驗室采用如圖裝置制備氣體(不考慮尾氣處理),不合理的是( )
5.在實驗室采用如圖裝置制備氣體(不考慮尾氣處理),不合理的是( )A.NO B.SO2 C.O2 D.Cl2 組卷:6引用:2難度:0.8 -
 6.已知X、Y、Z、M、N均為短周期主族元素。25℃時,各元素最高價氧化物對應水化物的溶液(濃度均為0.01mol?L-1)的pH和原子序數的關系如圖所示。下列說法正確的是( )
6.已知X、Y、Z、M、N均為短周期主族元素。25℃時,各元素最高價氧化物對應水化物的溶液(濃度均為0.01mol?L-1)的pH和原子序數的關系如圖所示。下列說法正確的是( )A.原子半徑大小順序:Z>Y>X B.五種元素的氫化物均為共價化合物 C.最高價氧化物對應的水化物的酸性:M>N D.Z的常見氧化物中陰、陽離子個數比均為1:2 組卷:10引用:3難度:0.5
二、非選擇題(共4題,共58分)
-
17.亞氯酸鈉(NaClO2)具有強氧化性,主要用于棉紡、亞麻、紙漿漂白、食品消毒、水處理、殺菌滅藻和魚藥制造等方面。某興趣小組利用如圖裝置制備亞氯酸鈉,并對其性質進行探究。

已知:二氧化硫與氯酸鈉在酸性條件下反應生成二氧化氯氣體。
回答下列問題:
(1)實驗證明裝置A中使用70%的濃硫酸效果最好,原因為。
(2)裝置B中,盛放氯酸鈉溶液和稀硫酸的儀器名稱為。
(3)一段時間后,C裝置中有NaClO2晶體析出,則C裝置中發生的化學反應方程式為,裝置C采用冷水浴的原因為。
(4)裝置D的作用為。
(5)取ag裝置C中的晶體,加水溶解,配成100mL溶液。取25mL加入稀硫酸酸化的足量的KI溶液中充分反應,再加入淀粉作指示劑,用濃度為cmol?L-1的硫代硫酸鈉標準溶液滴定,滴定終點消耗硫代硫酸鈉溶液VmL(已知:I2+2S2O32-═S4O62-+2I-)。
①NaClO2與稀硫酸酸化的KI溶液反應的離子方程式為。
②滴定終點的現象為。
③晶體中NaClO2的質量分數為(用含a、c和V字母的式子表示)。組卷:10引用:2難度:0.5 -
18.水體中氮含量過高會對水中生物構成安全威脅,氨氮硝氮是氮的主要存在形態。
(1)某工業氨氮廢水的處理流程如圖所示: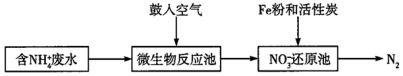
①寫出“微生物反應池”中反應的離子方程式:。
②“NO3-還原池”通過形成鐵碳原電池對廢水中的NO3-等進行處理,寫出NO3-在正極發生的電極反應:。
(2)向氨氮廢水中加入NaClO,可以將NH4+最終氧化為N2。NaClO除去水中氨氮的反應過程如下:
i.ClO-+H2O?OH-+HClO
ii.NH4++H2O?NH3?H2O+H+
ii.NH3?H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH-=H2O
①寫出反應iv的離子方程式:。
②廢水中氨氮去除率與初始pH有關。保持其他條件不變,隨初始pH的升高,溶液中c(HClO)(填“增大”“不變”或“減小”,下同),c(NH3?H2O)。
③研究發現,保持其他條件相同,廢水中氨氮去除率隨溫度的升高先升高后降低。當溫度>35℃時,氨氮去除率隨溶液溫度升高而降低的原因可能是(答一條)。
(3)利用雙離子交換膜電解法可以處理含NH4NO3的工業廢水,并獲得氨水和硝酸,原理如圖所示: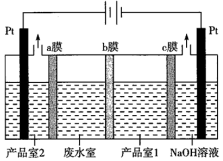
b膜屬于(填“陰”或“陽”)離子交換膜;為增強溶液的導電性,電解前產品室2中的溶液應是。組卷:24引用:2難度:0.5


