2021-2022學年江蘇省常州市八校高三(上)調研化學試卷(12月份)
發布:2024/4/20 14:35:0
一、單項選擇題(本題包括14小題,每題3分,共42分。每小題只有一個選項符合題意)
-
1.化學與科技、社會、生產、生活密切相關,下列有關說法不正確的是( )
A.用乙醚從黃花蒿中提取青蒿素 B.第五形態的碳單質--“碳納米泡沫”,與石墨烯互為同分異構體 C.維生素C又稱“抗壞血酸”,能幫助人體將食物中攝取的、不易吸收的Fe3+轉變為易吸收的Fe2+,這說明維生素C具有還原性 D.2018年10月23日,港珠澳大橋開通,大橋共用鋼鐵42萬噸,水泥189萬噸,其中鋼鐵屬于合金,水泥屬于傳統無機非金屬材料 組卷:17引用:2難度:0.6 -
2.在二氯化鉑的HCl溶液中,通入乙烯氣體,再加入KCl,可得K[Pt(C2H4)Cl3]?H2O(蔡氏鹽)。下列相關表示正確的是( )
A.KCl的電子式: 
B.中子數為117,質子數為78的鉑原子: Pt195117C.乙烯的結構簡式:CH2CH2 D.氯離子的結構示意圖:  組卷:1引用:1難度:0.6
組卷:1引用:1難度:0.6 -
3.閱讀下列資料,完成3~5題:碳是生命的核心元素,碳及其化合物在工農業生產中有著廣泛 的應用。工業上用 CO2生產 CH3OH 燃料,其熱化學方程式為 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ?mol -1。燃煤燃燒時生成的CO2用氨的飽和NaCl溶液吸收,可得到NaHCO3等化工產品。CO2會引起溫室效應,我國力爭在2060年前實現“碳中和”。“碳中和”是指企業、團體或個人測算在一定時間內直接或間接產生的溫室氣體排放總量,然后通過植物造樹造林、節能減排等形式,抵消自身產生的排放量,CO2實現“零排放”。
下列碳及其化合物的性質與用途具有對應關系的是( )A.炭能燃燒,可用作除味劑 B.CO具有還原性,可用于鐵的冶煉 C.Na2CO3易溶于水,可用于去除油污 D.NaHCO3能與堿反應,可用于烘焙糕點 組卷:1引用:0難度:0.80 -
4.閱讀下列資料,完成3~5題:碳是生命的核心元素,碳及其化合物在工農業生產中有著廣泛 的應用。工業上用 CO2生產 CH3OH 燃料,其熱化學方程式為 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ?mol -1。燃煤燃燒時生成的CO2用氨的飽和NaCl溶液吸收,可得到NaHCO3等化工產品。CO2會引起溫室效應,我國力爭在2060年前實現“碳中和”。“碳中和”是指企業、團體或個人測算在一定時間內直接或間接產生的溫室氣體排放總量,然后通過植物造樹造林、節能減排等形式,抵消自身產生的排放量,CO2實現“零排放”。
對于反應CO2(g)+3H2(g)=CH3OH(g)+H2O(g),下列有關說法正確的是( )A.增大CO2的值,可提高H2的轉化率 B.升高溫度能提高CO2的反應速率和轉化率 C.達平衡時縮小容器體積,v(正)增大,v(逆)減小 D.1molCO2和3molH2充分反應時放出的熱量為49.0kJ 組卷:4引用:0難度:0.80 -
5.閱讀下列資料,完成3~5題:碳是生命的核心元素,碳及其化合物在工農業生產中有著廣泛 的應用。工業上用 CO2生產 CH3OH 燃料,其熱化學方程式為 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ?mol -1。燃煤燃燒時生成的CO2用氨的飽和NaCl溶液吸收,可得到NaHCO3等化工產品。CO2會引起溫室效應,我國力爭在2060年前實現“碳中和”。“碳中和”是指企業、團體或個人測算在一定時間內直接或間接產生的溫室氣體排放總量,然后通過植物造樹造林、節能減排等形式,抵消自身產生的排放量,CO2實現“零排放”。
下列選項所述措施均能實現“碳中和”的是( )
①減少化石燃料使用
②發展捕集技術
③燃煤中加入石灰石
④開發新的能源A.①②④ B.①②③ C.①③④ D.①②③④ 組卷:0引用:0難度:0.80
二、非選擇題,(共58分)
-
17.某廢催化劑主要成分為活性炭和(CH3COO)2Zn,以該廢催化劑為原料回收活性炭并制備超細ZnO的實驗流程如圖1:
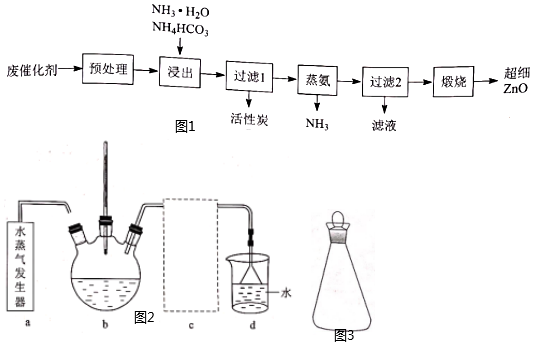
(1)浸出時ZnO轉化為[Zn(NH3)4]2+,參加反應的n(NH3?H2O):n(NH4HCO3)=3:1該反應的離子方程式為。
(2)蒸氨時控制溫度為95℃左右,在裝置b中[Zn(NH3)4]2+轉化為堿式碳酸鋅沉淀。實驗室模擬蒸氨裝置如圖2所示。
①用水蒸氣對裝置b加熱時,連接裝置a、b的導管應插入裝置b的位置為。(填序號)
A.液面上方但不接觸液面
B.略伸入液面下
C.伸入溶液底部
②在不改變水蒸氣的溫度、浸出液用量和蒸氨時間的條件下,為提高蒸氨效率和鋅的沉淀率,可采取的措施是(寫出一種)。
(3)46℃、pH約為6.8時,ZnSO4溶液與Na2CO3溶液反應可得堿式碳酸鋅。實驗室以含少量CuO的ZnO結塊廢催化劑為原料制備堿式碳酸鋅,設計實驗方案:,過濾,洗滌,干燥。(須使用的試劑:稀H2SO4、鋅粉、Na2CO3溶液)
(4)所回收的活性炭的吸附性能可通過測定其碘吸附值(1g活性炭能夠吸附的碘的質量)分析。測量方法如下:
①將活性炭粉碎并干燥,稱取0.5000g試樣,放入100mL碘量瓶(如題圖所示)中,加入10.00mLHCl溶液,加熱微沸后冷卻至室溫,再加入50.00mL0.1000mol?L-1I2標準溶液,蓋好瓶塞,振蕩一段時間,迅速過濾;
②取10.00mL濾液放入另一碘量瓶,加入100mLH2O,用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗Na2S2O3溶液的體積為10.00mL。
計算該樣品的碘吸附值(mg?g-1)。(寫出計算過程,實驗過程中溶液的體積變化忽略不計)已知:I2+S2O32-→I-+S4O62-(未配平)組卷:7引用:1難度:0.5 -
18.水體中的過量的硝態氮(主要以NO3-的形式存在)是一種重要污染物,可利用合適的還原劑將其還原為N2除去。
(1)納米鐵粉(Fe)具有還原性強、比表面積大、吸附性能良好等優點。實驗室制取納米鐵粉的反應原理是通過強還原劑來還原溶液中的Fe2+、Fe3+。
①在室溫下,向FeSO4溶液中滴加NaBH4溶液,得到Fe、B(OH)3沉淀和H2,反應的離子方程式為。
②制備納米鐵粉的反應過程中需要不斷通入N2,否則得到的鐵粉會導致硝態氮的去除率下降,其原因可能是。
(2)相同條件下,向含有50mg?L-1NO3-的兩份水樣中分別加入納米鐵粉、納米鐵粉-活性炭-銅粉,水樣中NO3-的去除速率差異如圖1所示,產生該差異的可能原因有。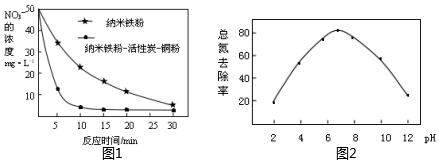
(3)向含有一定濃度的水樣中加入納米鐵粉,并調節溶液的pH,溶液中的總氮去除率與pH的關系如圖2所示。pH>7時,隨著pH的升高,溶液中的總氮去除率逐漸降低,其原因是。組卷:45引用:1難度:0.5


