2014-2015學(xué)年四川省成都七中高二(下)第3周周練化學(xué)試卷(6月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題3分,滿分60分)
-
1.下列說法不正確的是( )
A.氫氧燃料電池要進(jìn)入廣泛的實(shí)際應(yīng)用,高容量?jī)?chǔ)氫材料的研制是需解決的關(guān)鍵技術(shù)問題之一 B.目前科學(xué)家已經(jīng)制得單原子層鍺,其電子遷移率是硅的10倍,有望取代硅用于制造更好的晶體管 C.2013年6月航天員王亞平在太空做的水膜實(shí)驗(yàn)說明:水分子的組成和結(jié)構(gòu)在太空中發(fā)生了改變,水才有不同于其在地球上的物理現(xiàn)象 D.元素分析儀可檢驗(yàn)C、H、O、N、S等非金屬元素,也可以檢驗(yàn)Cr、Mn等金屬元素 組卷:135引用:2難度:0.9 -
2.下列說法正確的是( )
A.某烷烴的名稱為2,2,4,4-四甲基-3,3,5-三乙基己烷 B.等質(zhì)量的甲醛與乳酸[CH3CH(OH)COOH]完全燃燒消耗氧氣的量不相等 C.如圖是某有機(jī)物分子的比例模型,該物質(zhì)可能是一種氨基酸 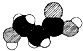
D.化合物 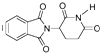 在酸性條件下水解,所得溶液加堿后加熱有NH3生成組卷:70引用:3難度:0.7
在酸性條件下水解,所得溶液加堿后加熱有NH3生成組卷:70引用:3難度:0.7 -
3.氨氮廢水中的氮元素多以NH4+和NH3?H2O的形式存在,在一定條件下,NH4+經(jīng)過兩步反應(yīng)被氧化成NO3-,兩步反應(yīng)的能量變化示意圖如圖所示:

下列說法合理的是( )A.該反應(yīng)的催化劑是NO2- B.升高溫度,兩步反應(yīng)速率均加快,有利于NH4+ 轉(zhuǎn)化成NO3- C.在第一步反應(yīng)中,當(dāng)溶液中水的電離程度不變時(shí),該反應(yīng)即達(dá)平衡狀態(tài) D.1 mol NH4+在第一步反應(yīng)中與1 mol NO2-在第二步反應(yīng)中失電子數(shù)之比為1:3 組卷:223引用:8難度:0.7 -
4.有機(jī)物
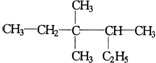 的正確命名為( )
的正確命名為( )A.2-乙基-3,3-二甲基-4-乙基戊烷 B.3,3-二甲基-4-乙基戊烷 C.3,3,4-三甲基己烷 D.2,3,3-三甲基己烷 組卷:155引用:108難度:0.9 -
5.研究化學(xué)反應(yīng)原理對(duì)于生產(chǎn)、生活及環(huán)境保護(hù)具有重要意義.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+O2(g)═H2O(l)△H=-285.84kJ?mol-112
則H2SO4溶液中Cu與H2O2反應(yīng)生成Cu2+和H2O的△H為( )A.+319.68kJ?mol-1 B.+259.7kJ?mol-1 C.-319.68kJ?mol-1 D.-259.7kJ?mol-1 組卷:276引用:11難度:0.7 -
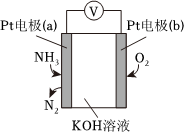 6.電化學(xué)氣敏傳感器可用于監(jiān)測(cè)環(huán)境中NH3的含量,其工作原理示意圖如圖。下列說法不正確的是( )
6.電化學(xué)氣敏傳感器可用于監(jiān)測(cè)環(huán)境中NH3的含量,其工作原理示意圖如圖。下列說法不正確的是( )A.O2在電極b上發(fā)生還原反應(yīng) B.溶液中OH-向電極a移動(dòng) C.反應(yīng)消耗的NH3與O2的物質(zhì)的量之比為4:5 D.負(fù)極的電極反應(yīng)式為:2NH3-6e-+6OH-=N2+6H2O 組卷:330引用:20難度:0.9 -
7.下列離子方程式書寫正確的是( )
A.向NaHCO3溶液中加入足量的Ba(OH)2溶液:2 +Ba2++2OH-=BaCO3↓+2H2O+HCO-3CO2-3B.向亞硫酸鈉溶液中滴入少量新制的氯水:3 +Cl2+H2O=SO2-3+2Cl-+2SO2-4HSO-3C.電解KBr溶液時(shí)陰極的電極反應(yīng)式為:K++e-=K D.將Fe2O3固體投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O 組卷:118引用:2難度:0.9 -
8.下列實(shí)驗(yàn)操作對(duì)應(yīng)的實(shí)驗(yàn)現(xiàn)象和解釋或結(jié)論都正確的是( )
選項(xiàng) 實(shí)驗(yàn)操作 實(shí)驗(yàn)現(xiàn)象 解釋或結(jié)論 A 把SO2通入紫色石蕊試液中 紫色褪去 SO2具有漂白性
B向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加足量的CuCl2溶液 先產(chǎn)生白色沉淀,然后沉淀變藍(lán)色 Ksp[Cu(OH)2]>Ksp[Mg(OH)2] C 向某溶液中滴加KSCN溶液 溶液變紅色 溶液中含有Fe2+ D 將充滿NO2的密閉玻璃球浸泡在熱水中 紅棕色變深 反應(yīng)2NO2(g)?N2O4(g)的△H<0 A.A B.B C.C D.D 組卷:25引用:2難度:0.9
二、解答題(共5小題,滿分0分)
-
24.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質(zhì)),實(shí)驗(yàn)室利用毒重石制備BaCl2?2H2O的流程如下:
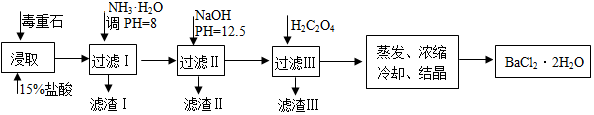
(1)毒重石用鹽酸浸取前需充分研磨,目的是。實(shí)驗(yàn)室用37%的鹽酸配制15%的鹽酸,除量筒外還需使用下列儀器中的。
a.燒杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3?H2O調(diào)節(jié)pH=8可除去(填離子符號(hào)),濾渣Ⅱ中含(填化學(xué)式)。加入H2C2O4時(shí)應(yīng)避免過量,原因是。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用間接酸堿滴定法可測(cè)定Ba2+的含量,實(shí)驗(yàn)分兩步進(jìn)行。Ca2+ Mg2+ Fe3+ 開始沉淀時(shí)的pH 11.9 9.1 1.9 完全沉淀時(shí)的pH 13.9 11.1 3.2
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步驟Ⅰ:移取xml一定濃度的Na2CrO4溶液與錐形瓶中,加入酸堿指示劑,用b mol?L-1鹽酸標(biāo)準(zhǔn)液滴定至終點(diǎn),測(cè)得滴加鹽酸體積為V0mL。
步驟Ⅱ:移取y mLBaCl2溶液于錐形瓶中,加入x mL與步驟Ⅰ相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol?L-1鹽酸標(biāo)準(zhǔn)液滴定至終點(diǎn),測(cè)得滴加鹽酸的體積為V1mL。
滴加鹽酸標(biāo)準(zhǔn)液時(shí)應(yīng)使用酸式滴定管,“0”刻度位于滴定管的(填“上方”或“下方”)。BaCl2溶液的濃度為mol?L-1,若步驟Ⅱ中滴加鹽酸時(shí)有少量待測(cè)液濺出,Ba2+濃度測(cè)量值將(填“偏大”或“偏小”)。組卷:1430引用:13難度:0.7 -
25.工業(yè)制硫酸時(shí),利用催化氧化反應(yīng)將SO2轉(zhuǎn)化為SO3是一個(gè)的關(guān)鍵步驟.
(1)在標(biāo)準(zhǔn)狀況下,將a L由SO2和Cl2組成的混合氣體通入200mL 0.1mol/L的Fe2(SO4)3溶液中,充分反應(yīng)后,溶液的棕黃色變淺.向反應(yīng)后的溶液中加入足量的BaCl2溶液,將所得沉淀過濾、洗滌、干燥后稱重,其質(zhì)量為23.3g.則混合氣體中SO2的體積為L,a的取值范圍為:.
(2)某溫度下,SO2(g)+O2(g)?SO3(g)△H=-98kJ?mol-1.開始時(shí)在100L的密閉容器中加入4.012
mol SO2(g)和10.0mol O2(g),當(dāng)反應(yīng)達(dá)到平衡時(shí)共放出熱量196kJ,該溫度下平衡常數(shù)K=.
(3)一定條件下,向一帶活塞的密閉容器中充入2mol SO2和1mol O2,發(fā)生下列反應(yīng):
2SO2(g)+O2(g)?2SO3(g),達(dá)到平衡后改變下述條件,SO2、O2、SO3氣體平衡濃度都比原來增大的是(填字母).
A.保持溫度和容器體積不變,充入2mol SO3
B.保持溫度和容器體積不變,充入2mol N2
C.保持溫度和容器體積不變,充入0.5mol SO2和0.25mol O2
D.保持溫度和容器內(nèi)壓強(qiáng)不變,充入1mol SO3
E.升高溫度
F.移動(dòng)活塞壓縮氣體
(4)常溫時(shí),BaSO4的Ksp=1.08×10-10.現(xiàn)將等體積的BaCl2溶液與2.0×10-3mol/L的Na2SO4溶液混合.若要生成BaSO4沉淀,BaCl2溶液的最小濃度為mol/L.
(5)N2O5是一種新型硝化劑,其性質(zhì)和制備受到人們的關(guān)注.①一定溫度下,在恒容密閉容器中N2O5可發(fā)生下列反應(yīng):2N2O5(g)?4NO2(g)+O2(g)△H>0.
如表為反應(yīng)在T1溫度下的部分實(shí)驗(yàn)數(shù)據(jù):
則50s內(nèi)NO2的平均生成速率為t/s 0 50 100 c(N2O5)/mol?L-1 5.0 3.5 2.4 .
②現(xiàn)以H2、O2、熔融鹽Na2CO3組成的燃料電池,采用電解法制備N2O5,裝置如圖所示,其中Y為CO2.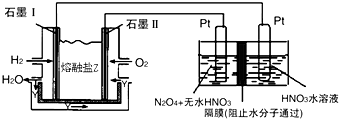
寫出石墨I(xiàn)電極上發(fā)生反應(yīng)的電極反應(yīng)式.組卷:21引用:2難度:0.5


