2021-2022學年江西省撫州市臨川一中高二(上)期末化學試卷
發布:2024/12/29 22:30:3
一.選擇題(本題包括16小題,每小題3分,共48分,每小題只有一個選項符合題意)
-
1.黨的十九屆四中全會明確指出“促進人與自然和諧共生”。下列有關做法不正確的是( )
A.將廢舊電池集中深埋,防止重金屬污染 B.提高車用燃油、燃氣品質,減少大氣污染 C.推廣使用高效、低毒農藥,減輕水體污染 D.使用可降解聚二氧化碳塑料,減少白色污染 組卷:16引用:2難度:0.6 -
2.下列實驗裝置與操作能達到相應目的的是( )
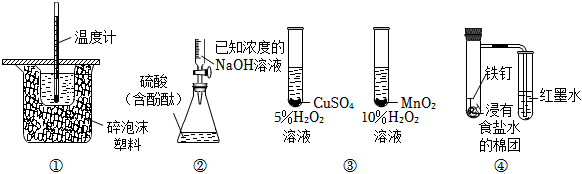
A.裝置①用于測定酸堿中和反應的反應熱 B.操作②是用已知濃度的NaOH滴定未知濃度的H2SO4 C.實驗③用于比較CuSO4 和MnO2 的催化活性 D.裝置④可用于觀察鐵的吸氧腐蝕 組卷:14引用:4難度:0.5 -
3.反應2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的熱量,該反應的速率表達式為v=k?cm(NO)?cn(H2)(k、m、n待測),該反應包含下列兩步:①2NO+H2═N2+H2O2(慢),②H2O2+H2=2H2O(快)。T℃時測得有關實驗數據如表:
下列說法錯誤的是( )序號 c(NO)(mol?L-1) c(H2)/(mol?L-1) 速率/(mol?L-1?min-1) Ⅰ 0.0060 0.0010 1.8×10-4 Ⅱ 0.0060 0.0020 3.6×10-4 Ⅲ 0.0010 0.0060 3.0×10-5 Ⅳ 0.0020 0.0060 1.2×10-4 A.正反應的活化能:①>② B.該反應的熱化學方程式為2NO(g)+2H2(g)═N2(g)+2H2O(g) ΔH=-332kJ?mol-1 C.整個反應速度由第①步反應決定 D.該反應速率表達式:v=5000c2(NO)?c(H2) 組卷:10引用:1難度:0.6 -
4.室溫下,某溶液中由水電離出的c(H+ )?c(OH-)=10-24,下列離子一定能大量共存的是( )
A.Fe3+、K+、S2-、NO3- B.K+、Na+、NO3-、SO42- C.NH4+、S2-、CH3COO-、Cl- D.Na+、HSO3-、CO32-、Cl- 組卷:47引用:1難度:0.7 -
5.下列關于化學反應進行的方向說法錯誤的是( )
A.凡是焓變小于零,熵變大于零的化學變化都能自發進行 B.由焓判據和熵判據組合而成的復合判據,更適合于所有的過程 C.自發反應的熵一定增大,非自發反應的熵一定減小 D.常溫下,反應C(s)+CO2(g)=2CO(g)不能自發進行,則該反應的ΔH>0 組卷:55引用:1難度:0.5 -
 6.電解質的電導率越大,導電能力越強。用0.100mol?L-1的 KOH溶液分別滴定體積均為20.00mL、濃度均為0.100mol?L-1的鹽酸和 CH3COOH溶液。利用傳感器測得滴定過程中溶液的電導率如圖所示。下列說法正確的是( )
6.電解質的電導率越大,導電能力越強。用0.100mol?L-1的 KOH溶液分別滴定體積均為20.00mL、濃度均為0.100mol?L-1的鹽酸和 CH3COOH溶液。利用傳感器測得滴定過程中溶液的電導率如圖所示。下列說法正確的是( )A.曲線②代表滴定CH3COOH溶液的曲線 B.N點溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+) C.M點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol?L-1 D.在相同溫度下,P點水電離程度大于M點 組卷:59引用:2難度:0.6 -
 7.網絡趣味圖片“一臉辛酸”,是在人臉上重復畫滿了辛酸的鍵線式結構(如圖)。在辛酸的同分異構體中,含有一個“-COOH”和三個“-CH3”的結構(不考慮立體異構),除
7.網絡趣味圖片“一臉辛酸”,是在人臉上重復畫滿了辛酸的鍵線式結構(如圖)。在辛酸的同分異構體中,含有一個“-COOH”和三個“-CH3”的結構(不考慮立體異構),除 外,還有( )
外,還有( )A.7種 B.11種 C.14種 D.17種 組卷:135引用:10難度:0.7
二、解答題(共5小題,滿分54分)
-
 20.降低能耗是氯堿工業發展的重要方向。
20.降低能耗是氯堿工業發展的重要方向。
(1)我國利用氯堿廠生產的H2作燃料,將氫燃料電站應用于氯堿工業,其示意圖如圖。
①a極為(填“正”或“負”)極。
②乙裝置中電解飽和NaCl溶液的化學方程式為。
③下列說法正確的是。
A.甲裝置可以實現化學能向電能轉化
B.甲裝置中Na+透過陽離子交換膜向a極移動
C.乙裝置中c極一側流出的是淡鹽水
④結合化學用語解釋d極區產生NaOH的原因:。
⑤實際生產中,陽離子交換膜的損傷會造成OH-遷移至陽極區,從而在電解池陽極能檢測到O2,產生O2的電極反應式為。下列生產措施有利于提高Cl2產量、降低陽極O2含量的是。
A.定期檢查并更換陽離子交換膜
B.向陽極區加入適量鹽酸
C.使用Cl-濃度高的精制飽和食鹽水為原料
(2)降低氯堿工業能耗的另一種技術是“氧陰極技術”。通過向陰極區通入O2,避免水電離的H+直接得電子生成H2,降低了電解電壓,電耗明顯減少。“氧陰極技術”的陰極反應為。組卷:80引用:10難度:0.6 -
21.硫代硫酸鈉(Na2S2O3)是一種重要的化工產品,將SO2通入Na2CO3和Na2S 混合溶液中可制得Na2S2O3.其制備裝置如圖所示。
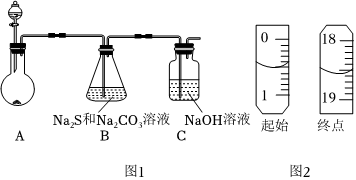
(1)A 中反應的化學方程式為。
(2)為保證Na2S 和Na2CO3得到充分利用,兩者的物質的量之比應為。
(3)為了保證硫代硫酸鈉的產量,實驗中通入的SO2不能過量,原因是。
(4)待Na2S和Na2CO3完全消耗后,結束反應。過濾B中的混合物,濾液經過、(填操作名稱)、過濾、洗滌、干燥,得到Na2S2O3?5H2O晶體。
(5)稱取10.0g產品(Na2S2O3?5H2O,相對分子質量為248),配成250mL溶液,取25.00 mL 溶液,以淀粉作指示劑,用 0.1000 mol/L 碘的標準溶液滴定。(反應原理為:2S2+I2═S4O2-3+2I-,忽略 Na2SO3 與I2反應)。O2-6
①滴定終點的現象為。
②重復三次的實驗數據如表所示,其中第三次讀數時滴定管中起始和終點的液面位置如圖所示,則x=,產品的純度為。實驗序號 消耗標準溶液體積/mL 1 19.98 2 17.90 3 x 組卷:16引用:4難度:0.5


