2021-2022學年天津九十五中益中學校高三(上)第二次月考化學試卷
發布:2024/4/20 14:35:0
一、單選題(本大題共12小題,共36.0分)
-
1.在密閉容器中,一定條件下進行如下反應:NO(g)+CO(g)?
N2(g)+CO2(g)ΔH=-373.2kJ?mol-1達到平衡后,為提高該反應的速率和NO的轉化率,可采取的措施是( )12A.加催化劑同時升高溫度 B.加催化劑同時增大壓強 C.升高溫度同時充入N2 D.降低溫度同時減小壓強 組卷:11引用:1難度:0.7 -
2.反應A(g)+3B(g)?2C(g)+2D(g)在四種不同情況下的反應速率分別如下,其中反應速率最大的是( )
A.vA=0.15mol?L-1?min-1 B.vB=0.6mol?L-1?min-1 C.vC=0.4mol?L-1?min-1 D.vD=0.01mol?L-1?s-1 組卷:46引用:8難度:0.7 -
3.下列各項敘述中,正確的是( )
A.N、P、As的電負性隨原子序數的增大而增大 B.價電子排布為4s24p5的元素位子第四周期VA族,是p區元素 C.2p和3p軌道形狀均為啞鈴形,能量也相等 D.氮原子的最外層電子排布圖: 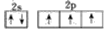 組卷:6引用:1難度:0.7
組卷:6引用:1難度:0.7 -
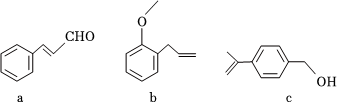 4.“分子機器人的設計與合成”是藥物化學研究的熱點之一,輪烷是一種分子機器的“輪子”。芳香族化合物a、b、c是合成輪烷的三種原料,其結構如圖所示,下列說法不正確的是( )
4.“分子機器人的設計與合成”是藥物化學研究的熱點之一,輪烷是一種分子機器的“輪子”。芳香族化合物a、b、c是合成輪烷的三種原料,其結構如圖所示,下列說法不正確的是( )A.b、c互為同分異構體 B.a、c分子中所有的碳原子均有可能處于同一平面上 C.a、b、c均能發生氧化反應、加成反應、加聚反應和酯化反應 D.a、b、c均能使酸性高錳酸鉀溶液和溴的四氯化碳溶液褪色 組卷:62引用:11難度:0.7 -
5.下列有關熱化學方程式的敘述正確的是( )
A.已知正丁烷(g)→異丁烷(g) ΔH<0,則異丁烷比正丁烷穩定 B.2H2(g)+O2(g)═2H2O(l)ΔH=-571.6kJ/mol,則H2燃燒熱ΔH=-571.6kJ/mol C.若2C(s)+2O2(g)═2CO2(g)ΔH1;2C(s)+O2(g)═2CO(g)ΔH2,則ΔH1>ΔH2 D.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ/mol,若將含0.5molH2SO4的稀硫酸與含0.5molBa(OH)2的稀溶液混合,放出的熱量等于57.3kJ 組卷:57引用:2難度:0.6
二、非選擇題(共64.0分)
-
15.根據信息回答下列問題:
Ⅰ用實驗確定某酸HA是弱電解質。兩同學的方案是:
甲:①稱取一定質量的HA配制0.1mol/L的溶液100mL;
②用pH試紙測出該溶液的pH值,即可證明HA是弱電解質。
乙:①用已知物質的量濃度的HA溶液、鹽酸,分別配制pH=1的兩種酸溶液各100mL;
②分別取這兩種溶液各10mL,加水稀釋為100mL;
③各取相同體積的兩種稀釋液裝入兩個試管,同時加入純度相同的鋅粒,觀察現象,即可證明HA是弱電解質。
(1)在兩個方案的第①步中,都要用到的定量儀器是。
(2)甲方案中,說明HA是弱電解質的理由是測得溶液的pH1(選填“>”、“<”、“=”);乙方案中,說明HA是弱電解質的現象是。
(a)裝HCl的試管中放出H2的速率快
(b)裝HA溶液的試管的中放出H2的速率快
(c)兩個試管中產生氣體速率一樣快
(3)請你評價:乙方案中不妥之處。
(4)請你再提出一個合理而比較容易進行的方案(藥品可任取),作簡明扼要表述。
Ⅱ.(5)食醋是日常飲食中的一種調味劑,國家標準規定釀造食醋中醋酸含量不得低于0.035g/mL。選擇酚酞作指示劑,用標準NaOH溶液可以測定食醋中醋酸的濃度,以檢測白醋是否符合國家標準。某品牌白醋的醋酸濃度測定過程如圖1所示,回答下列問題: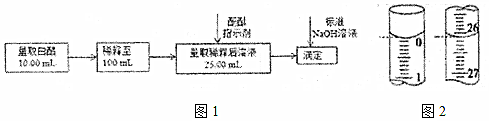
①滴定達到終點時的現象是
②某次實驗滴定開始和結束時,堿式滴定管中的液面如圖2所示,則所用NaOH溶液的體積為mL。
③若通過實驗測得稀釋后白醋的濃度為0.0600mol/L,則該白醋(填“符合”或“不符合”)國家標準。
④下列操作中,可能使所測白醋中醋酸的濃度數值偏低的是(填編號)。
A.堿式滴定管未用標準NaOH溶液潤洗就直接注入標準NaOH溶液
B.滴定前盛放白醋稀溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.滴定過程中振蕩時有液滴濺出
D.讀取NaOH溶液體積時,開始時仰視讀數,滴定結束時俯視讀數
E.堿式滴定管在滴定前有氣泡,滴定后氣泡消失組卷:7引用:1難度:0.7 -
16.汽車尾氣和燃煤尾氣是造成霧霾的主要原因之一。
(1)工業上利用甲烷催化還原NO,可減少氮氧化物的排放。
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ?mol-1
甲烷直接將NO2還原為N2的熱化學方程式為。
(2)減少汽車尾氣污染的原理為2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,向恒溫恒容密閉容器中充入NO和CO,用傳感器測得的數據如表所示:催化劑
①為了提高尾氣處理的效果,可采取的措施有時間/s 9 1 2 3 4 c(NO)/×10-3mol?L-1 9.00 4.00 2.00 1.00 1.00 c(CO)/×10-3mol?L-1 9.00 4.00 2.00 1.00 1.00 、(寫出兩種即可);
②此條件下達到平衡時,計算該反應的平衡常數K=。
(3)工業上用氫氧化鈉溶液來同時吸收SO2和氮的氧化物氣體(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常溫下,HNO2的電離常數為Ka=7×10-4,H2SO3的電離常數為Ka1=1.2×10-2,Ka2=5.8×10-8)。
①常溫下,相同濃度的Na2SO3、NaNO2溶液中pH較大的是溶液;
②常溫下,NaHSO3顯(填“酸”“堿”或“中”)性,判斷的理由是(通過計算說明)。組卷:4引用:1難度:0.7


