2021-2022學年上海交大附中高一(下)開學化學試卷
發布:2024/12/31 3:0:3
一、選擇題(每小題只有一個正確答案)
-
1.化學與人類生活、社會可持續發展密切相關,下列說法錯誤的是( )
A.新型冠狀病毒主要由C、H、O、N等元素組成,常用體積分數為75%的醫用酒精殺滅新型冠狀病毒 B.在月餅包裝盒中放入生石灰,能防止月餅氧化變質 C.用氯氣處理飲用水,在冬季的殺菌效果比在夏季好 D.防疫時期很多家庭都備有水銀溫度計,若不慎打破,應立即用硫黃粉末覆蓋 組卷:4引用:1難度:0.8 -
2.下列有關分散系說法正確的是( )
A.從外觀上無法區分FeCl3溶液和Fe(OH)3膠體 B.丁達爾效應是膠體和溶液的本質區別 C.將碳酸鈣經過特殊加工制成納米碳酸鈣,化學性質沒有明顯變化 D.Fe(OH)3膠體電泳的實驗中,陰極附近顏色加深,陽極附近顏色變淺,證明Fe(OH)3膠體帶正電 組卷:45引用:4難度:0.9 -
3.NA是阿伏加德羅常數的值。下列說法正確的是( )
A.22.4L(標準狀況)氮氣中含有7NA個中子 B.16.25gFeCl3加入沸水中形成的Fe(OH)3膠體粒子數為0.1NA C.2.0gCO2與SO2的混合氣體分子中,含有的質子數為NA D.1L1mol?L-1NaCl溶液含有28NA個電子 組卷:15引用:1難度:0.8 -
4.在甲、乙兩個體積不同的密閉容器中,分別充入質量相等的CO、CO2氣體時,兩容器的溫度和壓強均相同,則下列說法正確的是( )
A.充入的CO分子數比CO2分子數少 B.甲容器的體積比乙容器的體積小 C.CO的摩爾體積比CO2的摩爾體積小 D.若將壓強相同改為體積相同,則甲容器中的壓強比乙容器的壓強大 組卷:137引用:4難度:0.6 -
5.下列各組關于強電解質、弱電解質、非電解質的歸類,完全正確的是( )
A B C D 強電解質 CaCO3 NaCl Fe HNO3 弱電解質 H3PO4 NH3 CH3COOH Fe(OH)3 非電解質 C2H5OH BaSO4 C12H22O11(蔗糖) H2O A.A B.B C.C D.D 組卷:10引用:1難度:0.8 -
6.下列藥品的保存方法正確的是( )
A.氫氟酸保存在棕色細口玻璃瓶中 B.氯水密封于無色試劑瓶中 C.液溴易揮發,保存在帶有橡膠塞的棕色試劑瓶中,并應加水液封 D.碘單質保存在帶有玻璃塞的棕色廣口玻璃瓶中 組卷:20引用:2難度:0.7 -
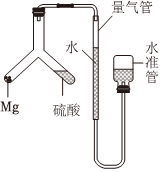 7.如圖所示實驗裝置測定氣體摩爾體積,相關敘述正確的是( )
7.如圖所示實驗裝置測定氣體摩爾體積,相關敘述正確的是( )A.實驗結束后未冷卻至室溫便讀數,會導致測定結果偏小 B.量氣管壓入水準管的水過多而溢出,會導致測定失敗 C.稱取質量為0.108g鋁帶誤作鎂帶用,會導致測定結果偏小 D.上提水準管后,量氣管液面高度不斷改變,說明裝置漏氣 組卷:81引用:2難度:0.8 -
8.為了配制95mL1mol?L-1NaOH溶液,下列說法錯誤的是( )
①選擇剛用蒸餾水洗凈的100mL容量瓶進行配制
②NaOH固體在燒杯里剛好完全溶解,立即把溶液轉移到容量瓶中
③用蒸餾水洗滌燒杯內壁和玻璃棒2~3次,洗滌液都轉移入容量瓶中
④定容時仰視刻度線,會導致溶液濃度偏高
⑤由于不慎,定容時液面超過了容量瓶的刻度線,這時采取的措施是使用膠頭滴管吸出液體超過的一部分A.②④⑤ B.①⑤ C.②③⑤ D.①② 組卷:11引用:1難度:0.7
二、綜合分析題
-
23.某無色溶液中含有K+、Cl-、OH-、SO32-、SO42-,為檢驗溶液中所含的某些負離子,限用的試劑有:鹽酸、硝酸、硝酸銀溶液、硝酸鋇溶液、溴水和酚酞試液。檢驗其中OH-的實驗方法省略,檢驗其他負離子的過程如圖所示。
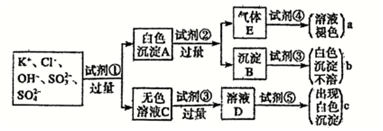
(1)圖中試劑①~⑤溶質的化學式分別是:①②③④⑤。
(2)圖中現象a、b、c表明檢驗出的離子分別是、、。
(3)白色沉淀A中加試劑②反應的離子方程式是。
(4)無色溶液C中加試劑③的主要目的是。
(5)白色沉淀A若加試劑③而不加試劑②,對實驗的影響是。組卷:36引用:1難度:0.6 -
24.硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫黃(S)共煮得到,裝置如圖。(已知:Na2S2O3在酸性溶液中不能穩定存在,會發生歧化反應。)
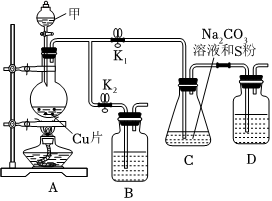
(1)步驟1:打開K1、關閉K2,向圓底燒瓶中加入足量甲(濃硫酸)并加熱,燒瓶中反應的化學方程式:Cu+2H2SO4(濃)CuSO4+SO2↑+2H2O生成物中,屬于非電解質的是△。每生成0.5mol還原產物,消耗Cu的質量為,該過程中體現出濃硫酸的性質。
(2)步驟2:始終保持C中溶液呈堿性,反應一段時間后,硫粉的量逐漸減少,打開K2、關閉K1并停止加熱。
①C中溶液須保持呈堿性,若呈酸性,則會發生和(都用離子方程式表示)。
②裝置B、D的試劑相同,均為。
步驟3:將C中所得混合物分離提純后得產品。
(3)利用反應2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2也能制備Na2S2O3。所需儀器如圖,按氣流方向連接各儀器,接口順序為a→g,h→,→,→d。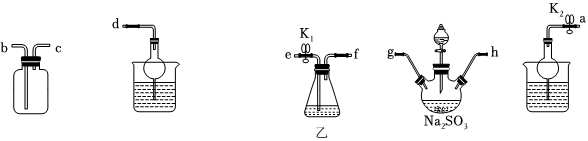
(4)Na2S2O3還原性強,工業上常用來除去溶液中殘留的Cl2,往溶液中加入適量的Na2S2O3溶液,使其恰好與殘留的Cl2完全反應,離子方程式為S2+4Cl2+5H2O═2O2-3+8Cl-+10H+,請設計實驗方案,證明溶液中有Cl-SO2-4。組卷:4引用:1難度:0.5


