2021-2022學年山東省臨沂市高三(上)質檢化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.化學與生產、生活密切相關。下列敘述正確的是( )
A.燃煤脫硫有利于實現“碳達峰、碳中和” B.SO2可漂白紙漿,不可用于殺菌、消毒 C.將“84”消毒液與75%酒精1:1混合,消毒效果更好 D.工業上可用離子交換法提高海帶中碘的提取率 組卷:18引用:2難度:0.7 -
2.下列有關物質的性質與用途具有對應關系的是( )
A.NH4HCO3受熱易分解,可用作氮肥 B.活性炭具有還原性,可用作制糖業的脫色劑 C.K2FeO4具有強氧化性,可用作自來水的消毒劑 D.CO2密度比空氣大,可用作鎂著火時的滅火劑 組卷:8引用:2難度:0.7 -
3.甲烷在一定條件下可生成碳正離子(CH3+)、碳負離子(CH3-)、甲基(-CH3)和碳烯(:CH2)等微粒。下列說法錯誤的是( )
A.CH4為非極性分子 B.CH3+和-CH3的空間結構均為平面三角形 C.鍵角:CH3+>CH3- D.CH3+和:CH2中碳原子雜化方式相同 組卷:74引用:2難度:0.6 -
4.實驗室提供的玻璃儀器有導管、酒精燈、容量瓶、燒杯、蒸餾燒瓶、漏斗、膠頭滴管(非玻璃儀器任選),選用上述儀器能完成的實驗是( )
A.制備氫氧化鐵膠體 B.除去乙醇中混有的乙酸 C.粗鹽的提純 D.配制0.1mol?L-1的硫酸溶液 組卷:16引用:2難度:0.7 -
5.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.100g質量分數為46%的甲酸水溶液中含有的氧原子數為2NA B.2.0g由H218O與D2O組成的物質中含有的中子數為NA C.常溫下,0.1mol環氧乙烷(  )中含有的σ鍵數目為0.3NA
)中含有的σ鍵數目為0.3NAD.標準狀況下,2.24LCl2溶于水所得溶液中含氯的微粒總數為0.2NA 組卷:12引用:2難度:0.5 -
6.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.中性溶液中:Na+、Fe3+、Cl-、SO42- B. =10-12溶液中:NH4+、Ca2+、Cl-、NO3-Kwc(H+)C.弱堿性溶液中:K+、Na+、I-、ClO- D.甲基橙變紅的溶液中:Na+、K+、Cl-、S2O32- 組卷:12引用:2難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.過硫酸鈉(Na2S2O8)是白色晶狀粉末,易溶于水,常用作漂白劑、氧化劑等。某化學小組對Na2S2O8的制備和性質進行探究。
I.實驗室制備Na2S2O8。
已知:①(NH4)2S2O8+2NaOHNa2S2O8+2NH3↑+2H2O55℃
②2NH3+3Na2S2O8+6NaOH6Na2SO4+N2+6H2O90℃
(1)Na2S2O8中過氧鍵的數目為;裝置A的加熱方式為;裝置B的作用是。
(2)反應過程需要持續通入N2的原因是。
Ⅱ.探究Na2S2O8的性質。
(3)將0.40mol過硫酸鈉與0.20mol硫酸配制成1L溶液,在一定條件下,測得溶液中部分微粒的濃度如圖所示(t時刻向溶液中加入少量MnO2)。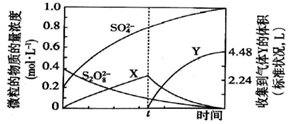
①t時刻前發生反應的離子方程式為。
②圖中氣體Y的化學式為;加入少量MnO2的目的是。
(4)工業上用Na2S2O8測定廢水中氮元素的含量。取100mL含NH4NO3的廢水,用cmol?L-1Na2S2O8標準溶液滴定(氮元素被氧化為NO3-,雜質不參加反應),達到滴定終點時消耗標準溶液的體積為VmL,則廢水中氮元素的含量為mg?L-1(用含c、V的代數式表示)。組卷:11引用:3難度:0.5 -
20.利用CO2、H2用為原料合成CH3OH可有效降低空氣中二氧化碳的含量,其中涉及的主要反應如下:
反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O (g)△H1<0
反應Ⅱ:CO2(g)+H2(g)?CO(g)+H2O (g)△H2=+40.9kJ?mol-1
回答下列問題:
(1)利用ΔH2計算ΔH1時,還需要利用反應的ΔH。
(2)使用新型催化劑,將1molCO2和2.44molH2在1L密閉容器中進行反應,CO2的平衡轉化率和甲醇的選擇率隨溫度的變化趨勢如圖所示。(甲醇的選擇率:轉化的CO2中生成甲醇的物質的量分數)
①達到平衡時,反應體系內甲醇的產量最高的是(填“D”、“E”或“F”)。
②553K時,反應Ⅰ的平衡常數K=。
③隨著溫度的升高,CO2的平衡轉化率增加,甲醇的選擇率降低,其原因為。
(3)研究表明,在電解質溶液中,CO2可以被電化學還原。
①CO2在堿性介質中電還原為甲醇的電極反應式為。
②兩種不同催化劑a、b上,CO2電還原為CO的反應進程中(H+電還原為H2同時發生)相對能量變化如圖。由此判斷,更易催化CO2電還原為CO的催化劑是(填“a”或“b”),理由是。 組卷:22引用:2難度:0.5
組卷:22引用:2難度:0.5


