2021-2022學年安徽省滁州市定遠縣育才學校(實驗班)高二(上)第三次月考化學試卷
發布:2024/9/13 16:0:8
一、選擇題(本大題共10小題,共40分)
-
1.下列與金屬腐蝕有關的說法,正確的是( )
A. 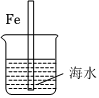
如圖,圖中,插入海水中的鐵棒,越靠近底端腐蝕越嚴重B. 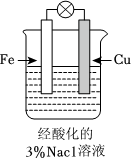
如圖,圖中,插入溶液中的鐵棒容易溶解,主要是發生電化學腐蝕C. 
如圖,圖中,燃氣灶的中心部位容易生銹,主要是由于高溫下鐵發生電化學腐蝕D. 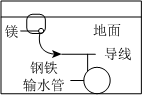
如圖,圖中,用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的負極組卷:26引用:10難度:0.7 -
2.下列說法正確的是( )
A.強酸跟強堿反應放出的熱量一定是中和熱 B.1 mol酸與1 mol堿完全反應放出的熱量是中和熱 C.在稀溶液中,強酸與強堿發生中和反應生成1 mol H2O(l)時的反應熱叫做中和熱 D.表示中和熱的離子方程式為H++OH-═H2O△H=-57.3 kJ/mol 組卷:6引用:2難度:0.9 -
3.研究反應2X(g)?Y(g)+Z(g)的速率影響因素,在不同條件下進行4組實驗,Y、Z起始濃度為0,反應物X的濃度(mol?L-1)隨反應時間(min)的變化情況如圖所示。下列說法不正確的是( )
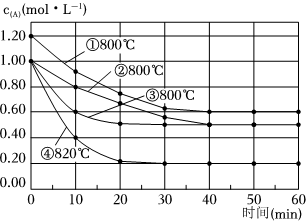
A.比較實驗②、④得出:升高溫度,化學反應速率加快 B.比較實驗①、④得出:升高溫度,化學反應速率加快 C.實驗③有可能使用了催化劑,催化劑加快正反應速率,對逆反應無影響 D.在0~10min之間,實驗②的平均速率v(Y)=0.01 mol?L-1?min-1 組卷:129引用:6難度:0.7 -
4.如圖所示為工業合成氨的流程圖。下列說法錯誤的是( )
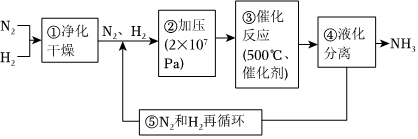
A.步驟①中“凈化”可以防止催化劑中毒 B.步驟②中“加壓”既可以提高原料的轉化率,又可以加快反應速率 C.步驟③、④、⑤均有利于提高原料平衡的轉化率 D.為保持足夠高的反應速率,應在反應達到一定轉化率時及時將氨從混合氣中分離出去 組卷:135引用:6難度:0.6 -
5.馬航失聯事件震驚中外,事件發生后,聯合搜救部門啟用了“金槍魚”水下搜救器展開水下搜救,其中Al-Ag2O電池是一種可用作水下動力的優良電源,其原理如圖所示。該電池工作時總反應式為2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,則下列說法錯誤的是( )

A.Al電極做負極,電極反應式為:Al-3e-+4OH-═ +2H2OAlO-2B.工作時電解液中的Na+移向Ag2O/Ag電極 C.工作時正極發生還原反應,負極不斷減重 D.當電極上生成1.08gAg時,電路中轉移的電子為0.005mol 組卷:2引用:2難度:0.5
二、實驗題(本大題共5小題,共60分)
-
14.重鉻酸鉀(K2Cr2O7)是一種強氧化劑,在實驗室和工業中都有廣泛應用。
(1)實驗室可用Cr2O3和KClO3制備重鉻酸鉀,具體步驟如下: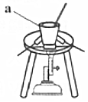
①取過量Na2CO3粉末放入右圖所示裝置中,加熱至融化。圖中儀器a的名稱是。
②稱取一定質量的CrO3和KClO3固體,研磨后加入到熔融的Na2CO3中,灼燒35mn后得到含鉻酸鈉(Na2CrO4)的固體及一種常見無色氣態化合物。該反應的化學方程式為。
③取出反應后的固體,加入少量水,加熱至沸騰,稍冷后過濾,將所得濾液倒入蒸發皿中,加入3mol?L-1H2SO4溶液至pH<5.寫出用pH試紙測溶液pH的操作。
④再加入適量氯化鉀,發生反應Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。
⑤加熱蒸發、冷卻結晶、過濾、洗滌、干燥,得到重鉻酸鉀晶體。
(2)工業上也可用電解鉻酸鉀的方法制備重鉻酸鉀(2CrO42-+2H+?Cr2O72-+H2O),電極為鈦基復合電極,反應原理如圖所示。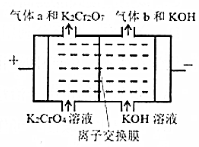
①寫出陽極的電極反應式。
②該電解池中應選擇(填“陰”或“陽”)離子交換膜。
(3)已知:固體Cr2O3灼熱時呈棕色,冷卻后為綠色,不溶于水,也不溶于酸。鉻酸銀為磚紅色固體,難溶于水。選用下列試劑及用品設計實驗方案檢驗重鉻酸鉀的熱分解產物(4K2Cr2O74K3CrO4+3O2↑+2Cr2O3)高溫
試劑及用品:鹽酸、AgNO3溶液、酒精燈、木條實驗步驟 現象 ①取重鉻酸鉀晶體于硬質玻璃管中,用酒精噴燈加熱 ②固體逐漸變成棕色 ③用排水集氣法收集產生的無色氣體, ④ ⑤取冷卻后的固體, ⑥產生磚紅色沉淀 組卷:24引用:3難度:0.5 -
15.通過電解ZnSO4、MnSO4的混合溶液得到普通干電池中的鋅與MnO2,某研究小組設計了如圖所示的實驗探究裝置。
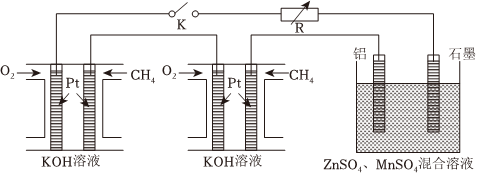
回答下列問題:
(1)燃料電池的優點是,圖中是將兩個甲烷燃料電池串聯后作為電源,負極的電極反應為。
(2)閉合開關K后,鋁電極上的產物是,一段時間后陽極附近溶液的pH(填“增大”、“不變”或“減小”),電解ZnSO4、MnSO4的混合溶液的陽極反應式為。
(3)假定燃料電池中的化學能完全轉化為電能,負極每消耗2.24L(標準狀況)CH4,電解池中回收制得19.5g單質Zn,電解池的能量利用率為。組卷:2引用:2難度:0.5


