2022年江蘇省南通市如皋市高考化學適應性試卷(4月份)(二)
發布:2024/4/20 14:35:0
一、單項選擇愿:共13題,每題3分,共39分.每題只有一個選項最符合題意.
-
1.為抑制新冠疫情的傳播,除做好個人防護外,也要做好環境物品等的消毒.下列物質不能用于消毒殺菌的是( )
A.酒精 B.明礬 C.次氯酸鈉 D.過氧乙酸(  )組卷:30引用:1難度:0.7
)組卷:30引用:1難度:0.7 -
2.配合物[Cu(NH3)4]Cl2可用于蝕刻銅,蝕刻后的產物[Cu(NH3)4]Cl可在氧氣中再生,再生反應為4[Cu(NH3)4]Cl+4NH4Cl+O2═4[Cu(NH3)4]Cl2+2H2O+4NH3,下列說法正確的是( )
A.基態Cu的電子排布式為[Ar]3d94s2 B.NH4Cl屬于共價化合物 C.NH3的晶體類型為原子晶體 D.[Cu(NH3)4]2+中與Cu2+形成配位鍵的原子是N 組卷:38引用:2難度:0.7 -
3.下列氯及其化合物的性質與用途具有對應關系的是( )
A.ClO2具有氧化性,可用于水體消毒 B.FeCl3具有酸性,可用于蝕刻線路板上的銅 C.HCl具有還原性,可用于除去鐵銹 D.NH4Cl受熱易分解,可用作氮肥 組卷:18引用:2難度:0.6 -
4.前4周期主族元素X、Y、Z、W的原子序數依次增大,基態時X原子s能級電子總數是p能級電子總數的2倍,Y最外層電子數是內層電子總數的一半,Y與Z、W在周期表中位置均相鄰。下列說法正確的是( )
A.第一電離能:Y>Z B.原子半徑:r(Y)<r(Z)<r(W) C.X的最高價氧化物對應水化物是強酸 D.簡單氣態氫化物的穩定性:Y<W 組卷:20引用:1難度:0.6 -
5.下列制取乙酸乙酯的實驗原理與裝置能達到實驗目的的是( )
A. 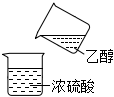 混合乙醇和濃硫酸
混合乙醇和濃硫酸B. 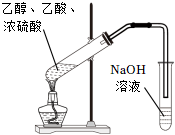 制取乙酸乙酯
制取乙酸乙酯C. 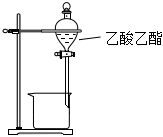 分離乙酸乙酯和水層
分離乙酸乙酯和水層D. 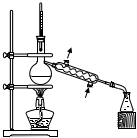 蒸出水層中的乙醇組卷:47引用:2難度:0.6
蒸出水層中的乙醇組卷:47引用:2難度:0.6
二、非選擇題:共4題,共61分
-
16.實驗小組以某銅渣(主要成分Cu、Cu2S,含少量Mn和Ag)為原料先制備硫酸銅,再由硫酸銅制備堿式碳酸銅[Cu2(OH)2CO3]。實驗包括如下過程。【已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2SO4)=1.4×10-5】
(1)浸取。將一定量的銅渣粉碎后加入到如圖-1所示的三頸燒瓶中,再通過分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液體的間隔利用二連球鼓入O2,銅渣充分反應后,向溶液中加入少量NaCl,過濾。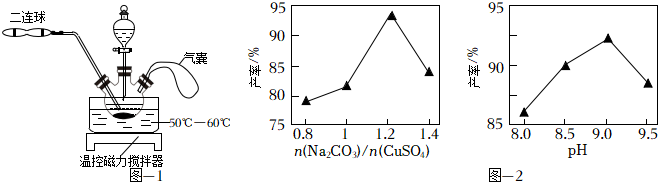
①已知浸取時無S和SO2生成,寫出浸取時Cu2S所發生反應的離子方程式:。
②滴加液體的間隔向三頸燒瓶內鼓入O2的目的是。
③當觀察到,可以停止鼓入O2。
④加入NaCl的目的是。
(2)制取CuSO4。
向濾液中加入NaOH溶液調節pH范圍為,過濾;向濾渣中加入稀硫酸至濾渣恰好完全溶解,得CuSO4溶液。{設Mn2+、Cu2+開始沉淀時c=1mol?L-1,沉淀完全時c<1.0×10-5mol?L-1。Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=1×10-13}
(3)制Cu2(OH)2CO3。
已知Cu2(OH)2CO3的產率{2n[Cu2(OH2CO3]×100%}隨起始n(Na2CO3)與n(CuSO4)的比值和溶液pH的關系如圖2所示。
①補充完整制取Cu2(OH)2CO3的實驗方案:向燒杯中加入30mL0.5mol?L-1Na2CO3溶液,將燒杯置于70℃的水浴中,,低溫烘干,得到Cu2(OH)2CO3。(實驗中可選用的試劑或儀器:0.5mol?L-1CuSO4溶液、1.0mol?L-1BaCl2溶液、0.1mol?L-1NaOH溶液、0.1mol?L-1鹽酸、pH計)
②實驗時發現,若反應時溶液pH過大,所得Cu2(OH)2CO3的產率偏低,但Cu元素含量偏大,原因是。組卷:43引用:2難度:0.3 -
17.有效去除煙氣中的NOx是環境保護的重要課題.
(1)O3能將NO和NO2轉化成綠色硝化劑N2O5.已知下列熱化學方程式:
2N2O5(g)═4NO2(g)+O2(g)ΔH=+106.2kJ?mol-1
2NO(g)+O2(g)═2NO2(g)ΔH=-114kJ?mol-1
2O3(g)═3O2(g)ΔH=-284.2kJ?mol-1
則反應2NO(g)+2NO2(g)+2O3(g)═2N2O5(g)+O2(g)的ΔH=.
(2)一種通過BaO和Ba(NO3)2的相互轉化脫除NO2的原理如圖1所示.脫除NO2的總反應為.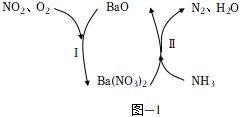
(3)NH3在催化劑作用下能與煙氣(主要為空氣,含少量NOx)中的NOx反應,實現NOx的脫除.常見的催化劑有V2O5等.反應的催化劑附在載體的表面,該載體為Ti的氧化物,其有兩種晶體類型,分別如圖2(a)、(b)所示,其中晶體a比表面積大,附著能力強,可用作載體,一定溫度下可轉化為晶體b.在V2O5催化下,NOx的脫除機理如圖3所示.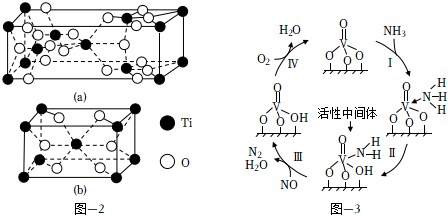
①晶體b的化學式為.
②轉化Ⅳ中,V元素化合價的變化為.
③脫除NOx時須控制反應的溫度,實驗發現,其他條件一定,當溫度過高時,NOx的脫除率會降低,原因除高溫下不利于NH3的吸附、催化劑本身活性降低外,還可能的原因是和.組卷:48引用:5難度:0.6


