2020-2021學年北京市昌平區高二(上)期末化學試卷
發布:2024/12/20 14:30:2
一、選擇題
-
1.下列過程中,將電能轉化為化學能的是( )
A. 
風力發電機B. 
天然氣燒水C. 
硅太陽能電池D. 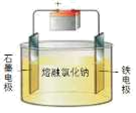
電解熔融氯化鈉組卷:60引用:4難度:0.8 -
2.下列物質不屬于弱電解質的是( )
A.氯化鈉 B.氫氟酸 C.醋酸 D.一水合氨 組卷:24引用:1難度:0.6 -
3.下列物質會發生水解的是( )
A.HCl B.NaOH C.CH3COOH D.Al2(SO4)3 組卷:144引用:1難度:0.6 -
4.有機物
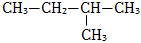 的名稱是( )
的名稱是( )A.1-甲基丁烷 B.2-甲基丁烷 C.3-甲基丁烷 D.1,1-二甲基丙烷 組卷:220引用:1難度:0.8 -
5.在一定溫度下的恒容密閉容器中發生反應:2SO2(g)+O2(g)?2SO3(g),下列證據能說明反應一定達到化學平衡狀態的是( )
A.Q=K B.體系內物質的總質量保持不變 C.SO2、O2、SO3同時在容器中存在 D.單位時間內消耗2nmol SO2,同時生成2nmol SO3 組卷:54引用:3難度:0.7 -
6.下列關于化學反應方向的說法正確的是( )
A.凡是放熱反應都是自發反應 B.凡是熵增大的反應都是自發反應 C.凡是吸熱反應都不是自發反應 D.反應是否自發,需要綜合考慮反應焓變和熵變 組卷:194引用:4難度:0.7 -
7.根據給出資料,判斷以下說法中不正確的是( )
資料:
其中k為反應速率常數。化學反應 反應速率與參與反應物質的濃度的關系式 ①H2+I2=2HI(氣體反應) v=kc(H2)c(I2) ②CO+NO2═CO2+NO v=kc2(NO2) A.對于反應①,增大H2濃度(其他條件不變),反應速率增大 B.對于反應①,增大I2濃度(其他條件不變),反應速率增大 C.對于反應②,增大CO濃度(其他條件不變),反應速率增大 D.對于反應②,增大NO2濃度(其他條件不變),反應速率增大 組卷:125引用:3難度:0.8 -
8.對室溫下的反應H2O2+2HI═I2+2H2O測得如下數據,0~20s間的反應速率v(H2O2)為( )
t/s c(H2O2)/mol/L 0 0.1 20 0.08 A.0.001mol?L-1?s-1 B.0.004mol?L-1?s-1 C.0.005mol?L-1?s-1 D.0.008mol?L-1?s-1 組卷:38引用:3難度:0.5 -
9.下列物質中不能使酸性KMnO4溶液褪色的是( )
A.乙烯 B.乙炔 C.苯 D.甲苯 組卷:26引用:4難度:0.5
二、解答題(共7小題,滿分0分)
-
27.某小組同學欲探究濃度對平衡的影響設計了如圖實驗:已知:Fe3++3SCN-?Fe(SCN)3K≈105
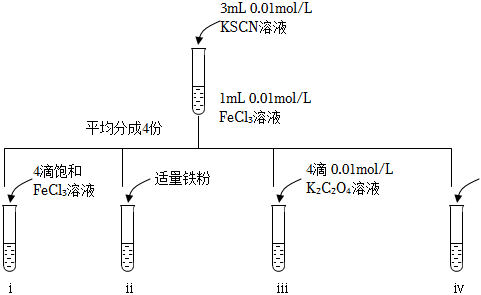
(1)ⅰ中觀察到的現象是,請結合化學用語用平衡移動原理進行解釋。
(2)ⅱ中觀察到溶液血紅色變淺,接近無色,原因是鐵粉參與了反應:,減小了c(Fe3+),使平衡向逆反應方向移動。
(3)ⅲ中觀察到溶液紅色褪去,對此現象產生的原因進行探究:
①甲同學查閱文獻后推測:草酸根(C2O42-)具有還原性,可能與Fe3+反應,產生一種氣體,該氣體的化學式是。
②乙同學查閱文獻后推測:Fe3+可能與C2O42-反應產生Fe(C2O4)33-(黃色)。用靈敏試劑檢驗試管ⅲ中產物,未檢出Fe2+,進一步論證后證實乙同學的推測較為合理。但是甲同學在12小時后檢驗ⅲ中產物,檢出了Fe2+,對此現象的合理解釋是。
(4)實驗ⅳ是的對照實驗。
a.實驗ⅰ
b.實驗ⅱ
c.實驗ⅲ組卷:45引用:2難度:0.7 -
28.CO2的資源化利用是“減少碳排放”背景下的科學研究熱點。
Ⅰ.利用CO2甲烷化反應:CO2(g)+4H2(g)?CH4(g)+2H2O(g)進行熱力學轉化。
(1)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ/mol
寫出CO2甲烷化反應的熱化學方程式。
(2)CO2甲烷化反應的平衡常數的表達式:K=。溫度升高,K。(填“增大”或“減小”)
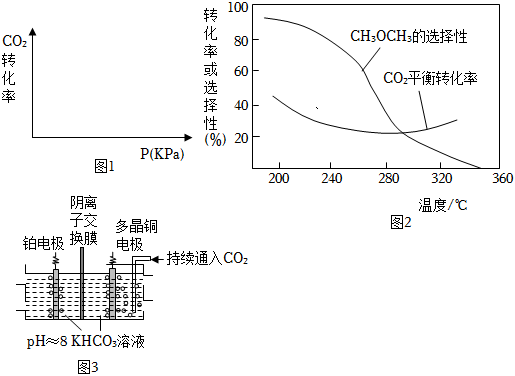
(3)在圖1中畫出其他條件不變時,一段時間內,壓強對CO2的轉化率的影響示意圖。
Ⅱ.CO2催化加氫合成二甲醚。其過程中主要發生下列反應:
反應ⅰ:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.2kJ?mol-1
反應ⅱ:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.5kJ?mol-1
在恒壓、CO2和H2的起始量一定的條件下,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖2所示。
(4)①溫度升高,平衡時CH3OCH3的選擇性下降的原因是。
②溫度高于300℃時,CO2平衡轉化率隨溫度升高而上升的原因是。
Ⅲ.電化學轉化
多晶Cu可高效催化CO2甲烷化,電解CO2制備CH4的原理示意圖如圖3。電解過程中溫度控制在10℃左右,持續通入CO2.陰、陽極室的KHCO3溶液的濃度基本保持不變。
(5)多晶Cu作(填“陰”或“陽”)極。
(6)陽極上發生的電極反應式是。
(7)陰離子交換膜中傳導的離子是,移動方向是。(填“從左向右”或者“從右向左”)組卷:41引用:1難度:0.7


