2020-2021學年江蘇省常州一中高二(上)期末化學試卷
發布:2024/11/24 9:30:6
一、單項選擇(每小題有且只有一個正確答案,每小題3分,共36分)
-
 1.如圖是某有機物分子的簡易球棍模型,該有機物中含C、H、O、N四種元素.下列關于該有機物的說法中錯誤的是( )
1.如圖是某有機物分子的簡易球棍模型,該有機物中含C、H、O、N四種元素.下列關于該有機物的說法中錯誤的是( )A.分子式為C3H7O2N B.能發生取代反應 C.能通過聚合反應生成高分子化合物 D.不能跟NaOH溶液反應 組卷:20引用:6難度:0.9 -
 2.一種芳綸纖維的拉伸強度比鋼絲還高,廣泛用作防護材料,其結構片段如圖。下列關于該高分子的說法正確的是( )
2.一種芳綸纖維的拉伸強度比鋼絲還高,廣泛用作防護材料,其結構片段如圖。下列關于該高分子的說法正確的是( )A.完全水解產物的單個分子中,苯環上的氫原子具有不同的化學環境 B.完全水解產物的單個分子中,含有官能團-COOH或-NH2 C.氫鍵對該高分子的性能沒有影響 D.結構簡式為:  組卷:991引用:30難度:0.8
組卷:991引用:30難度:0.8 -
 3.某天然有機化合物的結構簡式如圖所示,下列關于該化合物的說法正確的是( )
3.某天然有機化合物的結構簡式如圖所示,下列關于該化合物的說法正確的是( )A.該化合物可以發生消去反應 B.該化合物的分子式是C17H13O5 C.一定條件下,1 mol該化合物最多可以和7 mol H2發生加成反應 D.一定條件下,該化合物可以發生銀鏡反應 組卷:27引用:4難度:0.7 -
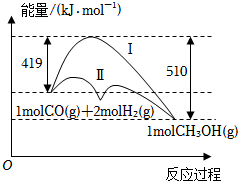 4.利用含碳化合物合成燃料是解決能源危機的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反應過程中的能量變化情況如圖所示,曲線Ⅰ和曲線Ⅱ分別表示不使用催化劑和使用催化劑的兩種情況。下列判斷正確的是( )
4.利用含碳化合物合成燃料是解決能源危機的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反應過程中的能量變化情況如圖所示,曲線Ⅰ和曲線Ⅱ分別表示不使用催化劑和使用催化劑的兩種情況。下列判斷正確的是( )A.每生成1mol CH3OH(g)吸收91kJ能量 B.加入催化劑,該反應的限度增大 C.反應物的總能量小于生成物的總能量 D.如果該反應生成液態CH3OH,釋放的能量增多 組卷:33引用:4難度:0.7 -
5.下列說法正確的是( )
A.1gH2和4gO2反應放出71.45kJ熱量,則氫氣的燃燒熱為142.9 kJ?mol-1 B.在稀溶液中,H+(aq)+OH-(aq)═H2O(1)△H=-57.3 kJ?mol-1,若將含0.5molH2SO4的濃硫酸與含1molNaOH的氫氧化鈉溶液混合,放出的熱量大于57.3kJ C.HCl和NaOH反應的中和熱△H=-57.3 kJ?mol-1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ?mol-1 D.1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷燃燒熱 組卷:26引用:4難度:0.9 -
 6.金屬鋰燃料電池是一種新型電池,比鋰離子電池具有更高的能量密度.它無電時也無需充電,只需更換其中的某些材料即可,其工作示意圖如下,下列說法正確的是( )
6.金屬鋰燃料電池是一種新型電池,比鋰離子電池具有更高的能量密度.它無電時也無需充電,只需更換其中的某些材料即可,其工作示意圖如下,下列說法正確的是( )A.放電時,空氣極為負極 B.放電時,電池反應為:4Li+O2=2Li2O C.有機電解液可以是乙醇等無水有機物 D.在更換鋰電極的同時,要更換水性電解液 組卷:174引用:6難度:0.7 -
7.電解法處理酸性含鉻廢水(主要含有Cr2
)時,以鐵板作陰、陽極,處理過程中存在反應Cr2O2-7+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列說法不正確的是( )O2-7A.陽極反應為Fe-2e-═Fe2+ B.電解過程中溶液pH不會變化 C.過程中有Fe(OH)3沉淀生成 D.電路中每轉移12mol電子,最多有1mol Cr2 被還原O2-7組卷:40引用:2難度:0.5
三、非選擇題(共40分,每空2分)
-
20.“綠水青山就是金山銀山”,近年來,綠色發展、生態保護成為中國展示給世界的一張新“名片”。汽車尾氣是造成大氣污染的重要原因之一,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一。請回答下列問題:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5 kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221 kJ/mol
若某反應的平衡常數表達式為:K=[c(N2)?c2(CO2)]/[c2(NO)?c2(CO)],則此反應的熱化學方程式為。
(2)N2O5在一定條件下可發生分解:2N2O5(g)?4NO2(g)+O2(g),某溫度下恒容密閉容器中加入一定量N2O5,測得N2O5濃度隨時間的變化如下表:
①反應開始時體系壓強為p0,第2 min時體系壓強為p1,則p1:p0=t/min 0 1 2 3 4 5 c(N2O5)/<mol?L-1) 1.00 0.71 0.50 0.35 0.25 0.17 。
2~5 min內用NO2表示的該反應的平均反應速率為。
②一定溫度下,在恒容密閉容器中充入一定量N2O5進行該反應,能判斷反應已達到化學平衡狀態的是。 (填字母)。
a.NO2和O2的濃度比保持不變 b.容器中壓強不再變化
c.2v正(NO2)=v逆(N2O5) d.氣體的密度保持不變
(3)Kp是用反應體系中氣體物質的分壓來表示的平衡常數,即將K表達式中平衡濃度用平衡分壓代替。已知反應:NO2(g)+CO(g)?NO(g)+CO2(g),該反應中正反應速率v正=k正?p(NO2)?p(CO),逆反應速率v逆=k逆?p(NO)?p(CO2),其中k正、k逆為速率常數,則Kp為(用 k正、k逆表示)。
(4)如圖是密閉反應器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,合成NH3反應達到平衡時,混合物中NH3的物質的量分數隨壓強的變化曲線,已知該反應為放熱反應。
①曲線a對應的溫度是。
②M點對應的H2的轉化率是。
(5)工業上常用氨水吸收二氧化硫,可生成(NH4)2SO3.判斷常溫下(NH4)2SO3溶液的酸堿性并說明判斷依據:。(已知:NH3?H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)組卷:63引用:2難度:0.5 -
 21.全釩液流電池的結構如圖所示,其電解液中含有釩的不同價態的離子、H+和SO42-.電池放電時,負極的電極反應為:V2+-e-=V3+.
21.全釩液流電池的結構如圖所示,其電解液中含有釩的不同價態的離子、H+和SO42-.電池放電時,負極的電極反應為:V2+-e-=V3+.
①電池放電時的總反應方程式為.充電時,電極M應接電源的極.
②若電池初始時左、右兩槽內均以VOSO4和H2SO4的混合液為電解液,使用前需先充電激活,充電過程陰極區的反應分兩步完成:第一步VO2+轉化為V3+;第二步V3+轉化為V2+.則第一步反應過程中陰極區溶液n(H+)(填“增大”、“不變”或“減小”),陽極的電極反應式為_.組卷:11引用:3難度:0.5


