2021-2022學年黑龍江省哈爾濱162中高二(上)期末化學試卷
發布:2024/11/3 8:30:2
一、選擇題(本題包括35小題,每小題只有一個正確選項,1-10每題1分,11-35每題2分,共60分)
-
1.決定化學反應速率的主要因素是( )
A.反應物的濃度 B.反應溫度 C.使用催化劑 D.反應物的性質 組卷:304引用:69難度:0.9 -
2.下列做法用到物質氧化性的是( )
A.明礬凈化水 B.純堿除去油污 C.臭氧消毒餐具 D.食醋清洗水垢 組卷:200引用:18難度:0.9 -
3.常溫下,在0.1mol?L-1 CH3COOH溶液中,水的離子積是( )
A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-15 組卷:108引用:20難度:0.9 -
4.在恒溫恒壓時,反應A+B═C+D在下列哪種情況下,一定能自發進行( )
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0 C.ΔH>0、ΔS>0 D.ΔH<0、ΔS>0 組卷:136引用:3難度:0.8 -
5.下列說法中,不正確的是( )
A.反應熱指的是反應過程中放出的熱量 B.中和反應都是放熱反應 C.伴隨著能量變化的過程不一定是化學反應 D.單液原電池中化學能轉化成電能和熱能 組卷:43引用:5難度:0.7 -
6.在恒溫、體積為2L的密閉容器中進行反應:2A(g)?3B(g)+C(g),若反應物在前20s由3mol將為1.8mol,則前20s的平均反應速率為( )
A.v(B)=0.03mol?L-1?s-1 B.v(B)=0.045mol?L-1?s-1 C.v(C)=0.03mol?L-1?s-1 D.v(C)=0.06mol?L-1?s-1 組卷:540引用:10難度:0.9 -
7.在一定條件下,對于密閉容器中進行的可逆反應:2HI (g)?H2(g)+I2(g),下列說法中,能說明這一反應一定達到化學平衡狀態的是( )
A.正、逆反應速率都等于零 B.HI、H2、I2的濃度相等 C.HI、H2、I2在容器中共存 D.HI、H2、I2的濃度均不再改變 組卷:28引用:14難度:0.9 -
8.已知反應X+Y=M+N為吸熱反應,對這個反應的下列說法中正確的是( )
A.X和Y的總能量一定低于M和N的總能量 B.X的能量一定低于M的,Y的能量一定低于N的 C.因為該反應為吸熱反應,故一定要加熱反應才能進行 D.破壞反應物中的化學鍵所吸收的能量小于形成生成物中化學鍵所放出的能量 組卷:56引用:163難度:0.9 -
9.在理論上可設計成原電池的化學反應是( )
A.C(s)+H2O(g)═CO(g)+H2(g) ΔH>0 B.Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3+10H2O(l) ΔH>0 C.CH4(g)+2O2(g)→CO2(g)+2H2O(l) ΔH<0 D.Mg3N2(s)+6H2O(l)═3Mg(OH)2(s)+2NH3(g) ΔH<0 組卷:31引用:1難度:0.6 -
10.下列物質的水溶液因為水解使溶液呈酸性的是( )
A.CH3COOH B.NaHSO4 C.NH4Cl D.CH3COONa 組卷:20引用:1難度:0.5 -
11.100℃時,Kw=1.0×10-12,若100℃某溶液中的c(H+)=1.0×10-7mol/L,則該溶液( )
A.呈中性 B.呈堿性 C.呈酸性 D. =2c(OH-)c(H+)組卷:14引用:1難度:0.7 -
12.對于有氣體參加的反應,一定能使化學反應速率加快的因素是( )
①擴大容器的容積 ②使用催化劑 ③增加反應物的物質的量 ④升高溫度 ⑤縮小容積 ⑥增大容器內的壓強.A.②③ B.②③④⑥ C.②④⑤ D.②④ 組卷:71引用:10難度:0.9
二、非選擇題(本題共包括3道題,共40分)
-
37.用活性炭還原處理氮氧化物,有關反應為C(s)+2NO(g)?N2(g)+CO2(g)。
(1)寫出上述反應的平衡常數表達式。
(2)在2L恒容密閉容器中加入足量C與NO發生反應,所得數據如表,回答下列問題。
①結合表中數據,判斷該反應的ΔH實驗編號 溫度/℃ 起始時NO的物質的量/mol 平衡時N2的物質的量/mol 1 700 0.40 0.09 2 800 0.24 0.08 0。(填“>”或“<”),理由是。
②判斷該反應達到平衡的依據是。
A.容器內氣體密度恒定
B.容器內各氣體濃度恒定
C.容器內壓強恒定
D.2v正(NO)=v逆(N2)
(3)700℃時,若向2L體積恒定的密閉容器中充入一定量N2和CO2發生反應:N2(g)+CO2(g)?C(s)+2NO(g);其中N2、NO物質的量隨時間變化的曲線如圖所示。請回答下列問題。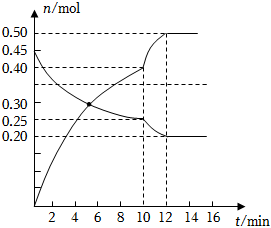
①0~10min內的CO2平均反應速率v=。
②圖中A點v(正)v(逆)(填“>”“<”或“=”)。
③第10min時,外界改變的條件可能是。
A.加催化劑
B.增大
B.增大C的物質的量
C.減小CO2的物質的量
D.升溫
E.降溫
(4)甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g) ΔH=+49.0kJ?mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g) ΔH=-192.9kJ?mol-112
又知③H2O(g)═H2O(l) ΔH=-44kJ?mol-1
則甲醇燃燒生成液態水的熱化學方程式。組卷:14引用:4難度:0.5 -
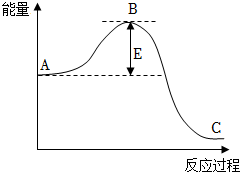 38.(1)工業合成氨N2(g)+3H2(g)?2NH3(g)反應過程中的能量變化如圖所示,據圖回答下列問題:
38.(1)工業合成氨N2(g)+3H2(g)?2NH3(g)反應過程中的能量變化如圖所示,據圖回答下列問題:
①該反應通常用活性鐵作催化劑,加催化劑會使圖中B點升高還是降低。
②該反應是反應(填“吸熱”或“放熱”)。
(2)已知下列熱化學方程式:
a.2H2(g)+O2(g)=2H2O(l)△H=-570kJ/mol,
b.H2(g)+O2(g)=H2O(g)△H=-142.8kJ/mol,12
c.C(s)+O2(g)=CO (g)△H=-55.5kJ/mol,12
d.C(s)+O2(g)=CO2(g)△H=-196.5kJ/mol
回答下列各問:
①上述反應中屬于放熱反應的是(填序號)。
②H2的燃燒熱為。
③寫出CO燃燒熱的熱化學方程式。
(3)發射衛星時可用肼(N2H4)為燃料,用二氧化氮為氧化劑,這兩種物質反應生成氮氣和水蒸氣。
已知:N2(g)+2O2(g)═2NO2(g) ΔH1=+33.5kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g) ΔH2=-267kJ/mol
試計算1mol肼和二氧化氮完全反應時放出的熱量為kJ,寫出肼與二氧化氮反應的熱化學方程式:。組卷:3引用:1難度:0.5


