2020-2021學年廣東省梅州市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、解答題(共10小題,滿分20分)
-
1.習近平總書記在2020年兩會上強調:牢固樹立生態優先綠色發展的導向,把祖國綠色長城構筑得更加牢固。下列行為不符合這一理念的是( )
A.開發太陽能、風能等新能源減少使用煤、石油等化石燃料 B.研究采煤、采油新技術,盡量提高產量以滿足工業生產的快速發展 C.發展生態農業,減少農藥對自然的傷害 D.減少資源消耗、增加資源的重復使用和資源的循環再生 組卷:20引用:1難度:0.6 -
2.下列說法正確的是( )
A.需要加熱才能進行的反應一定是吸熱反應 B.蒸干氯化銨溶液,得到氯化銨固體 C.用惰性電極電解飽和NaOH溶液,一段時間后仍為飽和溶液 D.H2、I2(蒸氣)、HI的平衡混合氣體加壓后顏色加深可以用平衡移動原理解釋 組卷:33引用:1難度:0.7 -
3.下列能證明乙酸是弱酸的事實是( )
A.乙酸能與純堿溶液反應放出CO2 B.飽和乙酸鈉溶液的pH>9 C.乙酸能電離出H+ D.乙酸溶液能使紫色石蕊溶液變紅 組卷:10引用:1難度:0.6 -
4.化學反應可視為舊鍵斷裂和新鍵形成的過程。共價鍵的鍵能是原子間形成1mol共價鍵(或其逆過程)時釋放(或吸收)的能量。已知H-H鍵的鍵能為436kJ?mol-1Cl-Cl鍵的鍵能為243kJ?mol-1,H-Cl鍵的鍵能為431kJ?mol-1,則H2(g)+Cl2(g)═2HCl(g)的反應熱(△H)等于( )
A.+183kJ?mol-1 B.-183kJ?mol-1 C.+862kJ?mol-1 D.-862kJ?mol-1 組卷:27引用:2難度:0.7 -
5.下列方程式書寫正確的是( )
A.NaHSO4在水溶液中的電離方程式NaHSO4═Na++H++SO42- B.H2SO3在水溶液中的電離方程式:H2SO3?2H++SO32- C.HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ D.CaCO3沉淀溶解平衡方程式:CaCO3(s)═Ca2+(aq)+CO32-(aq) 組卷:60引用:2難度:0.6 -
6.反應4A(g)+3B(g)═2C(g)+D(g),2min后B的濃度減少0.6mol?L-1 .對此反應速率的不正確表示是( )
A.用A表示的反應速率是0.4mol?L-1?min-1 B.用B、C、D表示反應速率,其比值是3:2:1 C.在2min末的反應速率,用B表示是0.3mol?L-1?min-1 D.在2min內的反應速率,用D表示是0.1mol?L-1?min-1 組卷:143引用:4難度:0.9
三、解答題(共4小題,滿分56分)
-
19.鎳廢渣(主要成分為Ni含少量Fe、Al、Fe3O4、Al2O3和不溶性雜質等)可用于合成“翠礬”(NiSO4?7H2O,M=28lg/mol)和氟鎳化鉀(K2NiF4),具體流程如圖。
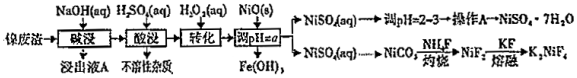
幾種金屬離子的氫氧化物沉淀pH如表:
請回答下列問題金屬離子 開始沉淀的pH 完全沉淀的pH Fe3+ 2.7 3.7 Fe2+ 7.6 9.7 Ni2+ 7.1 9.2
(1)“堿浸”過程中,為提高浸出率可采取的措施是(寫一種即可);寫出“堿浸”過程發生反應的其中一個離子方程式。
(2)“轉化”過程中加入H2O2的目的是。
(3)調pH=a,其中a的取值范圍是。
(4)將NiSO4溶液調pH=2~3,經蒸發濃縮、、過濾洗滌后得到NiSO4?7H2O。
(5)寫出“灼燒”NiCO3和NH4F的混合物時反應的化學方程式。
(6)準確稱取bg翠礬晶體產品于錐形瓶中加入足量的蒸餾水溶解配成250mL溶液,取25.00mL所配溶液于錐形瓶中,用cmol?L-1的標準溶液EDTA(Na2H2Y)滴定至終點(發生反應Ni2++H2Y2-═NiY2-+2H+),三次實驗消耗標準液的體積分別為20.02mL、19.98mL、19.40mL,則翠礬的純度為%。(不考慮雜質反應)組卷:10引用:1難度:0.4 -
20.某課外活動小組用如圖1裝置進行實驗,試回答下列問題。
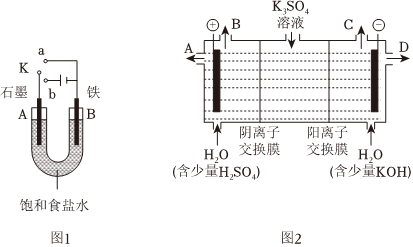
(1)若開始時開關K與a連接,則B極的電極反應式為。
(2)若開始時開關K與b連接,則總反應的離子方程式為;關于此實驗的說法正確的是(填序號)。
A.溶液中Na+向A極移動
B.從B極處逸出的氣體能使濕潤的KI淀粉試紙變藍
C.反應一段時間后通入適量HCl氣體可恢復到電解前電解質的濃度
D.若標準狀況下B極產生2.24L氣體,則有0.2mol電子發生轉移
(3)該小組同學認為,如果模擬工業上離子交換膜法制燒堿的方法,那么可以設想用如圖2裝置電解硫酸鉀溶液來制取氫氣、氧氣、硫酸和氫氧化鉀。
①B出口生成的氣體是。
②通電開始后,陰極附近溶液pH會增大,請簡述原因;通過陰離子交換膜的離子數(填“>”、“<”或“=”)通過陽離子交換膜的離子數。
③若將制得的氫氣、氧氣和氫氧化鉀溶液組合為氫氧燃料電池,則電池正極的電極反應式為。組卷:38引用:1難度:0.5


